
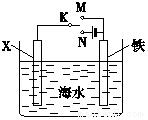
 利用如图装置,可以模拟铁的电化学防护.
利用如图装置,可以模拟铁的电化学防护.分析 (1)若K为碳棒,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe连接电源的负极;
(2)若K为锌,开关K置于a处,Zn为阳极被腐蚀,Fe为阴极被保护.
解答 解:(1)若X为碳棒,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe为电解池的阴极,电极反应为:2H++2e-=H2↑,故K连接N处,故答案为:N;2H++2e-=H2↑;
(2)若X为锌,开关K置于M处,Zn为负极被腐蚀,Fe为正极被保护,该防护法称为牺牲阳极的阴极保护法,正极反应为:O2+4e-+2H2O=4OH-,故答案为:牺牲阳极的阴极保护法;O2+4e-+2H2O=4OH-.
点评 本题考查了金属的腐蚀和防护原理,根据原电池中正负极上得失电子及电极反应式来分析解答即可,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
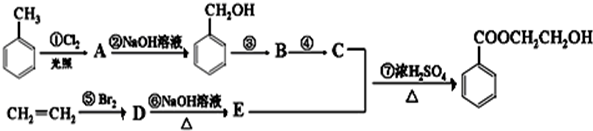
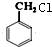 .
.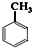 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl写出第⑥步反应的化学方程式:BrCH2CH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaBr.
+HCl写出第⑥步反应的化学方程式:BrCH2CH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
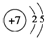 ;
;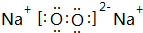 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15mol | B. | 0.3mol | C. | 0.05mol | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| B. | 23g Na 与足量H2O反应完全后可生成NA个H2分子 | |
| C. | 标准状况下,22.4LN2和H2混合气中含NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去8 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盛水的烧杯中投入小拇指头大小的钠块,观察现象 | |
| B. | 将一小块钠放在石棉网上加热,观察现象 | |
| C. | 实验后剩余的钠不能放回原瓶 | |
| D. | 用手掰开一块金属钠,观察钠的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质的质量分数w=$\frac{1000a}{17V}$100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$ (mol/L) | |
| C. | 溶液中c(OH-)=$\frac{b}{V}$ (mol/L) | |
| D. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
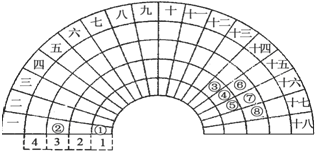
| A. | ③元素形成的单质晶体均属于原子晶体 | |
| B. | ④元素的气态氢化物易液化,是因为其分子间存在氢键 | |
| C. | ②、⑦、⑧对应的简单离子半径依次减小 | |
| D. | ②⑤⑦三种元素形成的盐溶液在25℃时的pH值为7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com