
下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
|
| A. | 相同浓度的两溶液中c(H+)相同 |
|
| B. | 100mL0.1mol/L的两溶液能中和等物质的量的氢氧化钠 |
|
| C. | pH=3的两溶液稀释100倍,pH都为5 |
|
| D. | 两溶液中分别加入少量对应的钠盐,c(H+)均明显减小 |
考点:
弱电解质在水溶液中的电离平衡.
专题:
电离平衡与溶液的pH专题.
分析:
A、醋酸是弱电解质,醋酸溶液中只有部分醋酸电离,氯化氢是强电解质.
B、相同物质的量的一元酸能中和相同物质的量的一元碱.
C、醋酸是弱电解质,加水稀释能促进醋酸的电离.
D、弱电解质溶液中,加入相同的弱根离子能抑制其电离.
解答:
解:A、醋酸是弱电解质,在其溶液中只有部分电离,氯化氢是强电解质,在其溶液中完全电离,所以相同浓度的两溶液中c(H+)不相同,故A错误.
B、醋酸和盐酸都是一元酸,等体积、等浓度的两种酸的物质的量相等,所以100mL0.1mol/L的两溶液能中和等物质的量的氢氧化钠,故B正确.
C、醋酸是弱电解质,醋酸溶液中只有部分醋酸电离,加水稀释能促进醋酸的电离,氯化氢是强电解质在其溶液中完全电离,所以pH=3的醋酸稀释100倍后溶液的PH小于5,PH=3的盐酸溶液稀释100倍,pH为5,故C错误.
D、醋酸是弱电解质,向醋酸溶液中加入醋酸钠溶液,因同离子效应导致抑制醋酸的电离,导致氢离子浓度降低【氯化氢是强电解质,不存在电离平衡,所以向盐酸溶液中加入氯化钠对其电离不影响,故D错误.
故选B
点评:
本题考查了弱电解质的性质,易错选项是D,注意D选项中根据外界条件对电离平衡的影响进行分析即可.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
在密闭容器中进行下列反应:
CO2(g)+C(s)⇌2CO(g)△H>0,起始通入2molCO,达到平衡后,改变下列条件,则指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):
(1)增加C,平衡 ,c(CO) .
(2)减小密闭容器的体积,保持温度不变,则平衡 ,c(CO2) .
(3)通入N2,保持密闭容器的体积和温度不变,则平衡 ,c(CO2) .
(4)保持密闭容器的体积不变,升高温度,则平衡 ,c(CO)
(5)恒压通入N2,CO2的百分含量
(6)恒压再通入2molCO,CO2的百分含量 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应的离子方程式的书写中,正确的是
A.C12通入水中:C12+H2O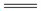 2H++Cl-+ClO-
2H++Cl-+ClO-
B.硫酸铝溶液与过量氨水反应:Al3++3NH3·H2O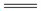 3
3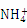 +Al(OH)3↓
+Al(OH)3↓
C.实验室用石灰石和盐酸反应制取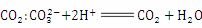
D.向Na2SO3溶液中加入稀硝酸:
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学分析Zn与稀H2SO4的反应。
(1)该反应的离子方程式是 。
(2)制H2时,用稀硫酸而不用浓硫酸,原因是_________。
(3)已知:Zn(s)+1/2O2(g) ZnO(s) ΔH=-332 kJ/mol
ZnO(s) ΔH=-332 kJ/mol
ZnO(s) + H2SO4(aq)  ZnSO4(aq) + H2O(l) ΔH =-112kJ/mol
ZnSO4(aq) + H2O(l) ΔH =-112kJ/mol
H2(g) +1/2 O2(g) H2O(l) ΔH =-286kJ/mol
H2O(l) ΔH =-286kJ/mol
则Zn与稀H2SO4反应生成1mol H2 时的反应热ΔH = kJ/mol。
(4)该同学用如下装置进行实验,分析影响反应速率的因素。

实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率______(填“快”或“慢”),主要原因是_________。
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是_________。
③ 从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有关溶液(均在常温下)的结论正确的是( )
|
| A. | pH=1的盐酸与pH=5的盐酸等体积混合后pH=3 |
|
| B. | 0.1mol/L醋酸溶液100 mL与0.2 mol/L氨水50 mL混合后能恰好完全中和 |
|
| C. | pH>7的溶液中不可能存在CH3COOH分子 |
|
| D. | 等浓度等体积的KOH溶液和CH3COOH溶液混合后:c(CH3COO﹣)=c(K+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液.
|
| A. | ②④⑥ | B. | ①② | C. | ②③⑤ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后,水蒸气的物质的量增加了4.5mol,则此反应的平均速率 (反应物的消耗速率或产物的生成速率)可表示为( )
(反应物的消耗速率或产物的生成速率)可表示为( )
|
| A. | v(NH3)=0.01mol/(L•s) | B. | v(O2)=0.03mol/(L•s) |
|
| C. | v(NO)=0.02mol/(L•s) | D. | v(H2O)=0.04mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
10ml浓度为0.1mol/LNaCL溶液和10ml浓度为0.1mol/L NaF溶液相比较阴离子数目( )
|
| A. | 相等 | B. | 前者大 | C. | 后者大 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com