
| A. | 醋酸溶液与NaOH反应:OH-+H+→H2O | |
| B. | 硝酸溶液和碳酸氢钠反应:H++2CO32-→CO2↑+H2O | |
| C. | 将溴水加入KI溶液中:Br2+2I-→I2+2Br- | |
| D. | CO2通入澄清石灰水:2OH-+CO2→H2O+CO32- |
分析 A.醋酸是弱电解质,不能拆成离子;
B.碳酸氢根离子为二元弱酸碳酸的酸根离子,在离子反应中不能拆分;
C.氧化性Br2>I2,KI溶液中加入溴水,可生成I2;
D.二氧化碳少量,氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,过量生成碳酸氢根离子.
解答 解:A.氢离子和氢氧根离子反应的离子方程式是溶液能全部电离出氢离子和全部电离出氢氧根离子的物质间的反应,醋酸溶液与NaOH反应,醋酸所示弱电解质不能拆成离子,该反应的离子方程式为:OH-+CH3COOH=CH3COO-+H2O,故A错误;
B.硝酸溶液和碳酸氢钠反应生成硝酸钠和水、二氧化碳,离子反应为:H++HCO3-=CO2↑+H2O,故B错误;
C.氧化性Br2>I2,KI溶液中加入溴水,可生成I2,反应的离子方程式为:Br2+2I-=I2+2Br-,故C正确;
D.少量二氧化碳与澄清石灰水反应生成碳酸钙、水,反应的离子反应为:Ca2+20H-+C02=H20+CaC03↓,二氧化碳过量,离子反应为:OH-+CO2=HCO3-,故D错误;
故选C.
点评 本题考查离子反应的书写,为高考常见题型,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | $\underset{\stackrel{\;}{C}}{•}$H2O | B. | $\underset{\stackrel{\;}{N}}{•}$2H4 | C. | $\underset{\stackrel{\;}{B}}{•}$F3 | D. | $\underset{\stackrel{\;}{C}}{•}$2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 molN2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30Mpa}^{催化剂}$2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 碳酸氢钠溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中氧化产物只有N2 | |
| B. | 当有0.4molCO2生成时,反应中转移的电子的总数目约为1.204×1024 | |
| C. | 若上述反应生成0.4molCO2,则溶液中阴离子增加的物质的量为2mol | |
| D. | 现取1L含CN-1.02mg/L的废水,至少需用4.0×10-5molCl2处理后才符合排放标准 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 邻-二溴苯只有一种 | |
| B. | 苯分子中所有原子在同一平面上 | |
| C. | 二甲苯没有同分异构体 | |
| D. | 苯既能发生加成反应也能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
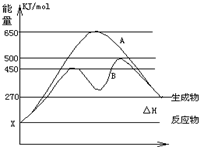 反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.试回答:
反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠保存在煤油里的原因之一是它极易与氧气反应 | |
| B. | 铝在空气中很容易燃烧 | |
| C. | 镁表面的氧化膜疏松,不能保护内层金属 | |
| D. | 铁锈的主要成分是Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com