
【题目】某铅酸蓄电池的工作原理如图所示,其总反应式为![]() 。下列判断不正确的是
。下列判断不正确的是
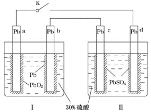
A.闭合K时,d电极的反应式为![]()
B.当电路中转移![]() 电子时,Ⅰ中消耗的
电子时,Ⅰ中消耗的![]() 为
为![]()
C.闭合K时,Ⅱ中![]() 向c电极迁移
向c电极迁移
D.闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极
【答案】C
【解析】
Ⅰ中两个电极不相同,Ⅱ中两个电极相同,闭合K时,Ⅰ为原电池,Ⅱ为电解池。Pb为负极,![]() 为正极,d为电解池的阳极,c为阴极。
为正极,d为电解池的阳极,c为阴极。
A. 闭合K时,d为电解池的阳极,阳极上硫酸铅失电子生成的氧化铅附着在d电极上,d电极的反应式为![]() ,故A正确;
,故A正确;
B. 闭合K时,Ⅰ为原电池,根据![]() 可知,每有
可知,每有![]() 硫酸参与反应,则转移
硫酸参与反应,则转移![]() 电子,故B正确;
电子,故B正确;
C. 闭合K时,Ⅱ为电解池,d为电解池的阳极,c为阴极,Ⅱ中硫酸根离子向阳极移动,即向d电极移动,故C错误;
D. d为电解池的阳极,c为阴极;Ⅱ中电解时,c极发生还原反应生成铅,d极发生氧化反应生成氧化铅,故电解一段时间后,Ⅱ也可作为原电池,d电极为正极,故D正确。
选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等有重要意义。
(1)用CO可以合成甲醇,已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJmol-1;
O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJmol-1;
CO(g)+![]() O2(g)=CO2(g) △H=-283.0 kJmol-1;
O2(g)=CO2(g) △H=-283.0 kJmol-1;
H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJmol-1;
O2(g)=H2O(l) △H=-285.8kJmol-1;
则CO(g)+2H2(g)![]() CH3OH(g) △H=___kJmol-1。
CH3OH(g) △H=___kJmol-1。
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是___(填写序号)。
a.使用催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为VL的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醛,平衡转化率与温度、压强的关系如图1所示。
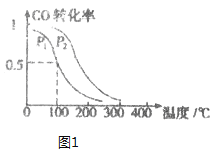
①P1___P2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=______;
③100℃,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、H2、CH3OH各0.5a mol,则平衡___(填“向左”“不”或“想右”)移动。
(4)利用原电池原理,用SO2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触,请写出该电池的负极的电极反应式___;
(5)Na2SO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为______。用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液,电解原理示意图如图2所示。请写出该电解池发生反应的化学方程式___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F都是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol·L-1D溶液的pH为13(25℃)。它们满足如图转化关系,则下列说法不正确的是
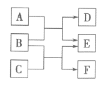
A. B晶体中阴、阳离子个数比为1:2
B. 等体积等浓度的F溶液与D溶液中,阴离子总的物质的量F>D
C. 0.1molB与足量A或C完全反应转移电子数均为0.1NA
D. Y、Z分别形成的简单氢化物的稳定性前者弱于后者,是因为后者分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2S是一种二元弱酸,回答以下问题:
(1)0.1mol/L NaHS溶液显碱性,则c(S2-)___________c(H2S)(填“大于” ,“小于” 或“等于” ) 。
(2)已知常温下,CaS饱和溶液中存在平衡:CaS(s)![]() Ca2+(aq)+S2-(aq) ΔH>0。
Ca2+(aq)+S2-(aq) ΔH>0。
①温度升高时,Ksp________ (填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)________,原因是__________________________________(用文字和离子方程式说明)。
(3)若向CaS悬浊液中加入Cu(NO3)2溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol/L氨水中逐滴加入0.1mol/L盐酸,测得溶液的pH随加入盐酸的体积变化如图所示。下列说法正确的是( )
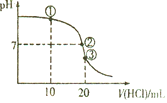
A.①溶液中:c(Cl-)=2c(NH4+)+2c(NH3·H2O)
B.②溶液中:c(NH4+)= c(Cl-)= c(OH-)= c(H+)
C.③溶液中:c(H+)= c(OH-)+ c(NH4+)+c(NH3·H2O)
D.滴定过程中可能出现:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中的信息判断,下列说法错误的是
序号 | 反应物 | 产物 |
① | Cl2、H2O2 | Cl-、…… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | KClO3、HCl | Cl2、KCl、H2O |
A.第①组反应的氧化产物为O2
B.第②组反应中C12与FeBr2的物质的量之比小于或等于1:2
C.第③组反应中生成3mol C12,转移6mol电子
D.氧化性由强到弱的顺序为C1O3- >C12>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2和N2O4可以相互转化:反应2NO2(g)![]() N2O4(g)△H=﹣57.2kJ/mol。
N2O4(g)△H=﹣57.2kJ/mol。
(1)一定温度下,现将1molN2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是___(填序号,下同)。
(2)若反应2NO2(g)N2O4(g)在体积为1L的恒容密闭容器中进行,保持温度不变,达到平衡后,向反应容器中再充入少量N2O4,平衡向___移动(填“左”、“右”或“不”),重新平衡后和原平衡相比,混合气体颜色___(填“变深”“变浅”或“不变”),N2O4 的体积分数___(填“增大”、“减小”或“不变”)。
(3)一定温度下,向容积为20L的密闭容器中充入1molNO2气体,发生反应2NO2(g)N2O4(g),反应中测得相关数据如表所示:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
气体相对分子质量 | 46 | 57 | 64 | 69 | 69 | 69 |
①此条件下该反应的化学平衡常数K=___。
②在50min末,向容器中加入![]() molNO2,若要保持平衡不发生移动,应加入N2O4为___mol。
molNO2,若要保持平衡不发生移动,应加入N2O4为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。
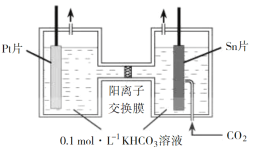
①写出阴极CO2还原为HCOO的电极反应式:________。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com