
有平衡体系CO(g)+2H2(g)═CH3OH(g)△H<0,为增加甲醇的产量,应采取的正确措施是( )
|
| A. | 高温、高压 | B. | 适宜的温度、高压、催化剂 |
|
| C. | 低温、高压、催化剂 | D. | 高温、高压、催化剂 |
考点:
化学平衡的影响因素.
专题:
化学平衡专题.
分析:
增加甲醇的产量,应改变条件使平衡向正反应方向移动,反应速率不能太低,且要加快反应速率,结合反应特征及外界条件对平衡移动、反应速率影响分析解答.
解答:
解:A.该反应正反应是体积减小的放热反应,增大压强平衡向正反应方向移动,有利于甲醇的生成,但升高温度平衡向逆反应方向移动,不利于甲醇的生成,不利于增加甲醇的产量,故A错误;
B.该反应正反应是体积减小的反应,增大压强平衡向正反应方向移动,有利于甲醇的生成,使用催化剂加快反应速率,适宜的温度使催化剂的活性高,且反应速率较快,有利于增加甲醇的产量,故B正确;
C.该反应正反应是体积减小的放热反应,增大压强平衡向正反应方向移动,有利于甲醇的生成,降低温度平衡向正反应方向移动,有利于甲醇的生成,但温度过低,反应速率较慢,催化剂的活性较差,不利于增加甲醇的产量,故C错误;
D.该反应正反应是体积减小的放热反应,增大压强平衡向正反应方向移动,有利于甲醇的生成,但升高温度平衡向逆反应方向移动,不利于甲醇的生成,高温下催化剂活性较差,不利于增加甲醇的产量,故D错误;
故选B.
点评:
本题考查反应条件的控制、外界条件对反应速率与平衡移动的影响,难度不大,注意是题目要求是增大产量不增大产率,容易按产率解答.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
已知H2(g)+Br2(l)═2HBr(g);△H=﹣72kJ/mol.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时 需要吸收的能量/KJ | 436 | a | 369 |
则表中a为( )
|
| A. | 404 | B. | 260 | C. | 230 | D. | 200 |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比KMnO4更强,本身在反应中被还原为Fe3+生成Fe(OH)3,达到净水目的,它是由Fe(NO3)3,NaOH和Cl2在一定条件下制得:
2Fe(NO3)3+16NaOH+3Cl2→□Na2FeO4+□NaNO3+□ +□H2O
(1)在横线上填上适当的物质,使制备Na2FeO4反应原理完整,并用双线桥法表示出点子转移的方向和数目 .
(2)反应使用的Fe(NO3)3可以用Fe粉和稀HNO3反应制(提示:反应过程中HNO3只被还原成NO),现在要制备Na2FeO483g的问:需要Fe粉 克,HNO3 克?
查看答案和解析>>
科目:高中化学 来源: 题型:
气态PCl5的分解反应为2PCl5(g)⇌2PCl3(g)+2Cl2(g),在473K达到平衡时气态PCl5有48.5%分解,在573K达到平衡时气态PCl5有97%分解,则此反应是( )
|
| A. | 吸热反应 |
|
| B. | 放热反应 |
|
| C. | 反应的焓变为零的反应 |
|
| D. | 无法判断是吸热反应还是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl﹣的位置用O2﹣代替,则下列对于KO2晶体结构的描述正确的是( )
|
| A. | 与K+距离相等且最近的O2﹣共有8个 |
|
| B. | 与K+距离相等且最近的O2﹣构成的多面体是正八面体 |
|
| C. | 与K+距离相等且最近的K+有8个 |
|
| D. | 一个KO2晶胞中的K+和O2﹣粒子数均为8个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
热化学方程式C(s)+H2O(g)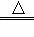 CO(g)+H2(g);△H=+131.3kJ/mol表示( )
CO(g)+H2(g);△H=+131.3kJ/mol表示( )
|
| A. | 碳和水反应吸收131.3kJ能量 |
|
| B. | 1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量 |
|
| C. | 1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ |
|
| D. | 1个固态碳原子和1分子水蒸气反应吸热131.1kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com