
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化物、氢化物都是只含二种元素 | |
| B. | 混合物中的元素一定是化合态的形式存在 | |
| C. | 金属氧化物一定是碱性氧化物 | |
| D. | 由一种元素组成的物质一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①②③ | C. | ③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:K+、NO3-、SO32-、Na+ | |
| B. | 使石蕊呈红色的溶液中:Na+、HCO3-、NO3-、AlO2- | |
| C. | 使pH试纸显红色的溶液中:Cu2+、Fe3+、NO3-、SO42- | |
| D. | 在酸性溶液中:NH4+、Na+、Cu2+、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素B5: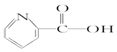 | B. | 阿司匹林: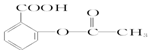 | ||
| C. | 芬必得: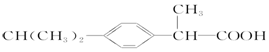 | D. | 摇头丸: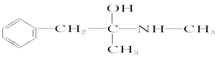 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③ | C. | ②③ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com