
| A、呈酸性 | ||
| B、呈碱性 | ||
| C、呈中性 | ||
D、
|
| Kw |
| 1.0×10-12 |
| Kw |
| 1.0×10-12 |


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
| A、将饱和FeCl3溶液逐滴加入沸腾的水中,可得到具有丁达尔现象的红褐色透明液体 |
| B、硅是制造光导纤维的材料 |
| C、用电解NaCl饱和溶液的方式可生产金属钠和氯气 |
| D、向某无色溶液中加入稀硫酸,无沉淀产生,再加入BaCl2溶液有白色沉淀出现,则该溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、[Na+]>[CO32-]>[HCO3-]>[OH-]>[H+] |
| B、[HCO3-]=[Na+]>[OH-]>[H+] |
| C、[Na+]=[HCO3-]+[CO32-]+[H2CO3] |
| D、[OH-]=[HCO3-]+2[H2CO3]+[H+] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O?H++OH- |
| B、HCO3-+H2O?CO32-+H3O+ |
| C、CO2+H2O?2CO3 |
| D、CO32-+H20?HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放热反应的反应速率总是大于吸热反应的反应速率 |
| B、2A(g)+B(g)=C(I)能自发进行,则该反应的△H<0 |
| C、甲烷的燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=-890.3KJ?mol |
| D、已知N2(g)+3H2(g)?2NH3(g)△H=-akJ?mol-1,将1molN2和3molH2充分反应,最终放热小于akJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
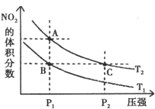 反应N2O4(g)?2NO2(g);△H=+57kJ/mol在温度T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是( )
反应N2O4(g)?2NO2(g);△H=+57kJ/mol在温度T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是( )| A、A,C两点的反应速率:A>C |
| B、B,C两点的反应速率:B=C |
| C、由状态B到状态A,可以用加热的方法 |
| D、A,C两点气体的颜色:A深,C浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ/mol | ||||
| B、CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3KJ/mol | ||||
C、
| ||||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com