
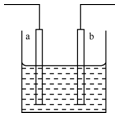
| A. | a,b可能是同种材料的电极 | |
| B. | 该装置可能是电解池,电解质溶液为稀硝酸 | |
| C. | 该装置可能是原电池,电解质溶液为稀盐酸 | |
| D. | 该装置可看作是铜一锌原电池,电解质溶液是稀硫酸 |
分析 根据Zn+2H+═Zn2++H2↑知,锌失电子发生氧化反应,氢离子得电子发生还原反应,该装置可能是原电池也可能是电解池,锌发生的反应可能是原电池负极也可能是电解池阳极上发生的反应,则氢离子发生的反应可能是原电池正极也可能是电解池阳极上发生的反应,如果是原电池,则锌作负极,比锌不活泼的金属或导电的非金属作正极,电解质溶液为酸溶液,如果是电解池,则阳极是锌,电解质溶液是酸或活动性顺序在氢之前的金属盐溶液,据此分析解答.
解答 解:A.如果该装置是电解池,如锌作阴、阳极,电解质溶液是酸,阳极上锌失电子,阴极上氢离子得电子,符合离子反应方程式,所以两个电极可以相同,故A错误;
B.该装置可能是电解池,电解质溶液是稀硝酸,锌作阳极,电解时,阳极上锌失电子,阴极上氢离子得电子,符合离子反应方程式,故B正确;
C、该装置可能是原电池,电解质溶液为稀盐酸,锌作负极,正极上氢离子得电子,发生的反应符合离子方程式,故C正确;
D、该装置可看作是铜-锌原电池,电解质溶液是稀硫酸,负极上锌失电子,正极氢离子得电子,符合离子方程式,故D正确.
故选A.
点评 本题考查了原电池和电解池原理,同时考查学生的发散思维能力,明确正、负极和阴、阳极上发生反应的类型是解本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ②④⑦ | B. | ①②⑦ | C. | ①④⑤ | D. | ②⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.5 g | B. | 7.2 g | C. | 9.3 g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每种烃的含氧衍生物中至少有3种元素 | |
| B. | 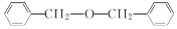 中含有的官能团为醚基 中含有的官能团为醚基 | |
| C. | 所有的有机物中都含有碳,多数含氢,其次还含有氧、氮、卤素、硫、磷等 | |
| D. | 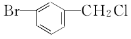 属于芳香卤代烃 属于芳香卤代烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有关物质的转化关系如图所示,固体X由两种常见元素组成,其中一种为常见金属元素,另一种为非金属元素,且质量比为14:1,B是常见的无色无味气体,可以使澄清石灰水变浑浊,C是一种红棕色气体,D是最常见的无色液体,E溶液遇硫氰化钾溶液显血红色,F是紫红色的金属单质,I是常见的无色气体,遇空气变为红棕色.
有关物质的转化关系如图所示,固体X由两种常见元素组成,其中一种为常见金属元素,另一种为非金属元素,且质量比为14:1,B是常见的无色无味气体,可以使澄清石灰水变浑浊,C是一种红棕色气体,D是最常见的无色液体,E溶液遇硫氰化钾溶液显血红色,F是紫红色的金属单质,I是常见的无色气体,遇空气变为红棕色. 
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 4:1 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
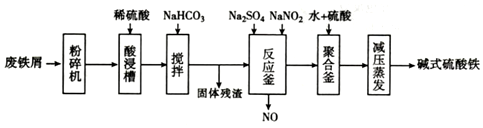
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com