
分析 发生Cl2+2KI=2KCl+I2,2n(I2)=n(KI),结合n=$\frac{m}{M}$计算.
解答 解:5000kg含KI0.3%(质量分数)的溶液中,m(KI)=5000×103g×0.3%=15000g,n(KI)=$\frac{15000}{166g/mol}$=90.36mol,则由Cl2+2KI=2KCl+I2可知,n(I2)=90.36mol×$\frac{1}{2}$=45.18mol,答:最多可得到碘单质的物质的量为45.18mol.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及物质的量计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:解答题
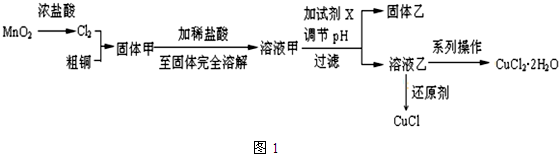
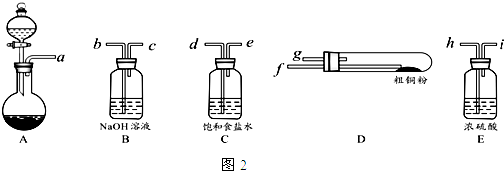
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
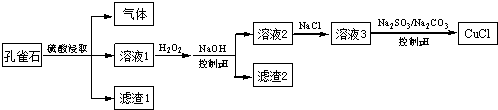
| A. | H2O2将溶液1中Fe2+氧化为Fe3+,再通过控制pH转化为Fe(OH)3除去 | |
| B. | SO32-将溶液3中的Cu2+还原,反应得到CuCl | |
| C. | CO32-作用是控制溶液pH,促使CuCl沉淀的生成 | |
| D. | 若改变试剂加入顺序,将溶液3缓慢加入到含大量SO32-/CO32-的溶液中,同样可制取CuCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
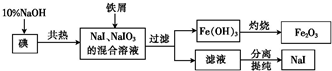
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | AlCl3 | C. | CaCl2 | D. | FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 30 | 40 | 50 | 60 |
| NH3生成量/10-6 mol | 4.8 | 5.9 | 6.0 | 6.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com