
工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l)(Ⅱ)
S(s)+Na2SO3(aq)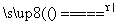 Na2S2O3(aq)(Ⅲ)
Na2S2O3(aq)(Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若________,则整个装置气密性良好。装置D的作用是_______ _______________________________________________________________。
装置E中为________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是____________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是_____________ ___________________________________________________________。
反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有 ________。
a.烧杯 b.蒸发皿
c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:
_____________________________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O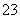 +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3 溶液
解析 (1)若装置不漏气,则长颈漏斗中会形成一段液柱并且液柱高度保持不变;装置D是安全瓶,可防止倒吸;装置E是尾气处理装置,用来吸收过量的SO2,故所盛溶液可以是NaOH溶液等。
(2)根据盖斯定律,由(Ⅰ)×2+(Ⅱ)+(Ⅲ)×3,得2Na2S(aq)+Na2SO3(aq)+3SO2(g)===3Na2S2O3(aq),故烧瓶C中Na2S和Na2SO3物质的量之比为2∶1。
(3)装置B中的溶液不能和SO2发生反应。蒸馏水溶解SO2;Na2SO3溶液能与SO2发生反应:SO2+Na2SO3+H2O===2NaHSO3;NaHCO3溶液也能与SO2发生反应:NaHCO3+SO2===CO2+NaHSO3;饱和NaHSO3溶液不能和SO2反应,也不溶解SO2。为使SO2缓慢进入烧瓶C,应使生成SO2的速率减慢,可通过控制滴加硫酸的速度来实现;因反应(Ⅲ)相对较慢,C中反应达到终点时S消耗完,现象是溶液变澄清。蒸发皿加热时不需垫石棉网;试管是小型玻璃仪器,加热时也不需垫石棉网;烧杯、锥形瓶底部面积大,防止受热不均匀,在加热时需垫石棉网。
(4)Na2S2O3和Na2SO3的存在对SO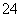 的检验有干扰,要先除去。根据题给信息,可先加入过量的稀盐酸将二者除去,排除干扰,再检验SO
的检验有干扰,要先除去。根据题给信息,可先加入过量的稀盐酸将二者除去,排除干扰,再检验SO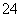 的存在。
的存在。
答案 (1)液柱高度保持不变 防止倒吸 NaOH(合理即可) (2)2∶1 (3)c 控制滴加硫酸的速度 溶液变澄清(或浑浊消失) ad (4)取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质


科目:高中化学 来源: 题型:
有一无色溶液,可能含有K+.Al3+.Mg2+.NH4+.Cl-.SO42-.HCO3-.MnO4-中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是
A.肯定有Al3+.Mg2+.NH4+.Cl- B.可能有K+.Cl-.MnO4-
C.肯定有Al3+.Mg2+.SO42- D.肯定有K+.HCO3-.MnO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列分离装置进行相应实验,能达到相应实验目的的是
( )。
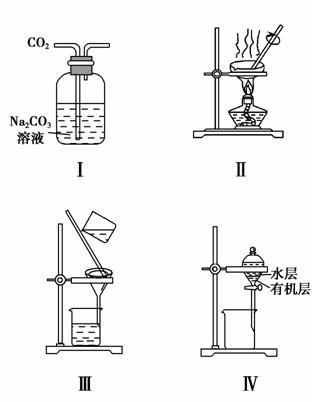
A.用图Ⅰ所示装置除去CO2中含有的少量HCl
B.用图Ⅱ所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图Ⅲ所示装置分离NaCl和Na2SO4的混合溶液
D.用图Ⅳ所示装置分离CCl4萃取碘水中的碘后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )。
A.SO2和SO3都是酸性氧化物,二者的水溶液都是强酸
B.将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化
C.硫粉在过量的纯氧中燃烧可以生成大量的SO3
D.富含硫黄的矿物在工业上可用于制造硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
在某溶液中加入BaCl2溶液,生成白色沉淀,加入稀硝酸,沉淀不溶解,则下列关于该溶液所含离子的推断中正确的是 ( )。
A.一定会有SO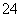
B.含有SO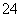 和Ag+
和Ag+
C.可能含有SO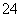 、Ag+、SO
、Ag+、SO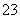 中的一种、两种或三种
中的一种、两种或三种
D.可能含有SO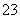 或CO
或CO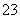
查看答案和解析>>
科目:高中化学 来源: 题型:
下列由相关实验现象所推出的结论正确的是 ( )。
A.NH4Cl和NH4HCO3受热都能分解,说明可以用加热NH4Cl或NH4HCO3固体的方法制氨气
B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO
C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
D.分别将充满HCl、NH3的烧瓶倒置于水中,液面均迅速上升,说明二者均易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置。

Ⅰ.浓硝酸的强氧化性实验
将铜片置于具支试管的底部,在分液漏斗中加入约5 mL浓硝酸,往具支试管中放入约2 mL浓硝酸,用排水法收集产生的气体。
(1)具支试管中发生反应的化学方程式:_________________________。
(2)实验中观察到能证明浓硝酸具有强氧化性的现象_______________ ______________________________________________________________。
Ⅱ.稀硝酸的强氧化性实验
(3)上述反应完成后,欲进一步证明稀硝酸也具有强氧化性,紧接的简便、合理的实验操作是_________________________________________。
(4)能证明稀硝酸与铜反应产生NO的实验现象是________(填写序号)。
A.c中收集到无色气体
B.c中收集到的无色气体接触空气后变为红棕色
C.b中产生的无色气体接触空气后变为红棕色
Ⅲ.实验反思
(5)利用该装置先进行铜与浓硝酸反应,再进行铜与稀硝酸反应的实验,其好处是____________________________________。
Ⅳ.问题讨论
用等质量的铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。对此有两种看法:
①两者颜色不同的原因是因为Cu2+浓度差异引起的。
②前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的。
(6)你认为上述看法________(填“①”或“②”)合理。若是①合理,说明理由,若是②合理,设计一个简单实验证明:______________________ _________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr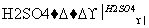 C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·mL-1);36 mL 浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题:
(1)该实验应选择下图中的a装置还是b装置________。
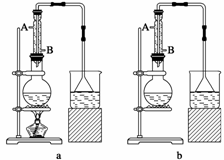
(2)反应装置中的烧瓶应选择下列哪种规格最合适( )
A.50 mL B.100 mL
C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是( )
A.A进B出 B.B进A出
C.从A进或B进均可
(4)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com