
某合成气的主要成分是一氧化碳和氢气,可用于合成甲醚等清洁燃料。由天然气获得该合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1=+206.1 kJ·mol-1
②CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH2=+247.3 kJ·mol-1
③CO(g)+H2O(g)CO2(g)+H2(g) ΔH3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示。

图1
反应进行的前5 min内,v(H2)=________;10 min时,改变的外界条件可能是______________________________________________________________。
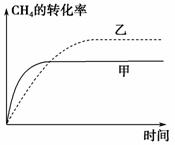
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。

(3)反应③中ΔH3=________。800 ℃时,反应③的平衡常数K=1,测得该温度下密闭容器中某时刻各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应③中正、逆反应速率的关系式是________(填代号)。
a.v正>v逆 B.v正<v逆
c.v正=v逆 D.无法判断
(4)用该合成气制取甲醚的化学方程式为______________________________。
该反应的原子利用率为________(设反应完全进行,用质量百分比表示)。
解析 (1)可根据图像先计算CH4的反应速率,再计算H2的生成速率。10 min时,改变的条件不可能是增大容器的体积(否则改变条件的瞬间CH4浓度应突然减小),由于c(CH4)减小,平衡右移,故改变的条件可能是升高温度(或充入水蒸气)。(2)甲容器反应开始后压强增大,乙容器压强不变、体积增大,可看成是由甲减压得到乙,故乙容器的反应速率慢,平衡右移,CH4的转化率大。(3)根据盖斯定律,反应①减去反应②即可得到反应③,进而通过计算求得ΔH3。根据浓度商: =0.94<K=1,可知反应向正反应方向进行,即
=0.94<K=1,可知反应向正反应方向进行,即
v正>v逆。(4)根据质量守恒定律可知,反应的化学方程式为2CO+4H2===CH3OCH3+H2O,可以求出甲醚质量占反应物总质量的71.9%。
答案 (1)0.3 mol·L-1·min-1 升高温度(或充入水蒸气)
(2)
(3)-41.2 kJ·mol-1 a
(4)2CO+4H2===CH3OCH3+H2O 71.9%


科目:高中化学 来源: 题型:
下列有关能量转化的认识不正确的是( )
A.通过植物的光合作用,太阳能转化为化学能
B.人类使用照明设备,将电能转化为光能
C.生物体内的化学变化过程在能量转化上比在体外发生的一些能量转化更为合理、有效
D.燃料燃烧,只是将化学能转化为了热能
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,溶液颜色有明显变化的是( )
A.少量明矾溶液加入到过量NaOH溶液中
B.往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液
C.少量Na2O2固体加入到过量NaHCO3溶液中
D.在酸性高锰酸钾溶液中滴入少量Fe2(SO4)3稀溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以提高尾气处理效果的是 ( )。
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是 ( )。
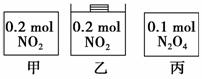
A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙
B.平衡时N2O4的百分含量:乙>甲=丙
C.平衡时甲中NO2与丙中N2O4的转化率不可能相同
D.平衡时混合物的平均相对分子质量:甲>乙>丙
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、M都是中学教材常见元素,下列对两个离子反应通式的推断中,其中正确的是( )
(甲) XO3n-+Xn- + H+ →X单质+ H2O(未配平); (乙)Mm++mOH-=M(OH)m↓
①若n=1,则XO3n-中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m
A.①③ B. ②③ C. ①② D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.据有关资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子。根据上述信息,完成下面两题:
(1)下列关于天然气水合物中两种分子描述正确的是
A.两种都是极性分子 B.两种都是非极性分子
C.H2O是极性分子,CH4是非极性分子 D.其中氧原子和碳原子的杂化方式均为sp3
E.其中氧原子和碳原子的杂化方式分别为sp2和sp3
(2)晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为
II.(1)兰聚氰胺分子的结构简式如图所示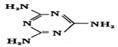 ,则其中氮原子轨道杂化类型是 ,l mol三聚氰胺分子中含 mol
,则其中氮原子轨道杂化类型是 ,l mol三聚氰胺分子中含 mol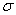 键。
键。
(2)某元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的M层电子排布式为____ 。
 (3)过渡金属配合物Ni( CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=____ 。
(3)过渡金属配合物Ni( CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=____ 。
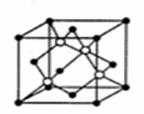
(4)碳化硅的晶胞结构(如右图)与金刚石类
似(其中“●”为碳原子,“○”为硅原子)。
图中“●”点构成的堆积方式与下列图式
中 所表示的堆积方式相同。

(5)碳化硅的结构中,设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为 (用含a、b、c的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气中CO、NOx 以及燃煤废弃中的SO2都是大气污染物,对它们的治理具有重要意义。
Ⅰ.CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1= —574 kJ·mol- 1 .
CH4(g) + 4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2= 一1160 kJ·mol- 1
(1)甲烷直接将NO2还原为N2的热化学方程式为 ;
Ⅱ.吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
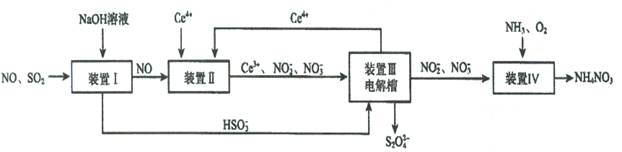
(2)装置Ⅱ中,酸性条件下,NO被Ce 4+ 氧化的产物主要是NO3- 、NO2- ,写出只生成NO3- 的离子方程式 ;
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
①生成的Ce4+ 从电解槽的 (填字母序号)口流出;
②生成S2O42 - 的电极反应式为 ;
(4)已知进入装置Ⅳ的溶液中,NO2- 的浓度为a g·L- 1 ,要
使1m3该溶液中的NO2- 完全转化为NH4NO3,至少需向装置Ⅳ
中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)


查看答案和解析>>
科目:高中化学 来源: 题型:
从下列事实所列出的相应结论正确的是
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| D | 常温下白磷可自燃,而氮气须在放电时才与氧 气反应 | 非金属性:P>N |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com