
 .
. .
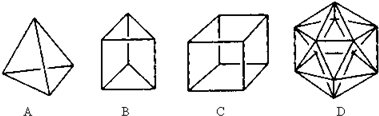
. 分析 (1)由链式结构可知含双键和三键;
(2)B为平面结构,与溴水发生1:1加成反应,加成方式有两种,说明是二烯烃,但加成产物只有一种,说明是环状二烯烃,
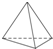
(3)C为正四面体,每个C原子分别与另三个C原子通过单键相连,则4个C形成正四面体结构;
解答 解:(1)由链式结构,可知含双键和三键,可以由两分子的乙炔加成而得结构简式为HC≡C-CH═CH2;
故答案为:HC≡C-CH═CH2;
(2)B为平面结构,与溴水发生1:1加成反应,加成方式有两种,说明是二烯烃,但加成产物只有一种,说明是环状二烯烃,则结构简式为: ;
;
故答案为: ;
;
(3)C为正四面体,每个C原子分别与另三个C原子通过单键相连,则4个C形成正四面体结构,结构简式为: ;
;
故答案为: ;
;
点评 本题考查了有机物结构简式的确定,题目难度中等,明确常见有机物结构为解答关键,(2)为易错点,需要根据题干信息正确判断其空间结构,试题培养了学生的分析、理解能力.


科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 试剂X | 离子方程式 |
| A | 透明溶液中:Fe3+、NH4+、SO42-、NO3- | 过量的铜粉 | 2Fe3++Cu=2Fe2++Cu2+ |
| B | Fe3+、Al3+、AlO2-、Cl- | 过量的盐酸 | AlO2+4H-=Al3++2H2O |
| C | Na、Ba2+、HCO3-、NO3- | NaHSO4溶液 | H-+HCO3=CO2↑+H2O |
| D | pH=0的溶液中:Mg2+,Fe2+、NO3-、SO42- | 双氧水 | 2Fe2++H2O2+2H-=2Fe3++2H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未来化学的研究方向是经验化 | B. | 化学不需要再做实验 | ||
| C. | 化学不再是纯实验学科 | D. | 化学不做实验,就什么都不知道 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
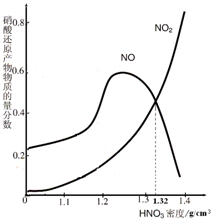 绿矾受热分解后的产物为不含硫元素的固体A、SO2、SO3和H2O.回答下列问题:
绿矾受热分解后的产物为不含硫元素的固体A、SO2、SO3和H2O.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
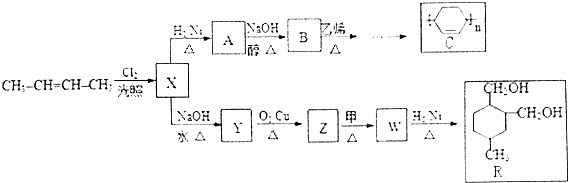
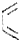 +
+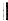 $\stackrel{△}{→}$
$\stackrel{△}{→}$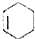
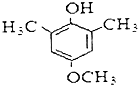 .
.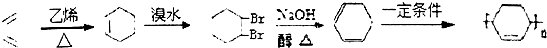 .(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)
.(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10-2 | B. | 102 | C. | 2 | D. | 12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com