
 与上述混合溶液中
与上述混合溶液中 相等
相等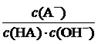 ="Ka(HA)/Kw" ,上述反应过程中,温度不变,Ka(HA)、Kw不变,故HA溶液中
="Ka(HA)/Kw" ,上述反应过程中,温度不变,Ka(HA)、Kw不变,故HA溶液中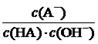 与上述混合溶液中
与上述混合溶液中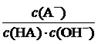 相等,正确;D、根据混合液中的物料守恒和电荷守恒式知,c(A-)-c(HA) ="2c" (H+)— 2 c (OH-),错误。
相等,正确;D、根据混合液中的物料守恒和电荷守恒式知,c(A-)-c(HA) ="2c" (H+)— 2 c (OH-),错误。

科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)ΔH=+890 kJ/mol |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=+890 kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890 kJ/mol |
D.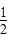 CH4(g)+O2(g)= CH4(g)+O2(g)=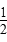 CO2(g)+H2O(l)ΔH=-890 kJ/mol CO2(g)+H2O(l)ΔH=-890 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.V1>V2>V3 | B.V1<V2<V3 |
| C.V1=V2>V3 | D.V1=V2<V3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.呈酸性 | B.呈中性 | C.呈碱性 | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com