
 ,A的名称是2-甲基戊烷. 若A是炔烃B氢化而成,则B的结构有2种
,A的名称是2-甲基戊烷. 若A是炔烃B氢化而成,则B的结构有2种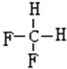 和
和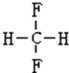 F.
F.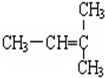 和
和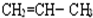 G.
G.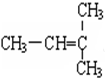 和
和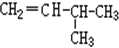
分析 (1) ,只存在单键,应为烷烃,主链为5个碳,在2号碳上含有1个甲基;烷烃分子中相邻碳原子上均带2个氢原子的碳原子间是对应炔存在C≡C的位置,据此解答即可;
,只存在单键,应为烷烃,主链为5个碳,在2号碳上含有1个甲基;烷烃分子中相邻碳原子上均带2个氢原子的碳原子间是对应炔存在C≡C的位置,据此解答即可;
(2)分子式为C4H10O属于醇类的有机物中,能被氧化生成醛,说明与羟基相连的碳上有2个氢原子,即具有-CH2OH结构的醇,根据同分异构体的知识来回答;
(3)丙烷失去1个H的基团为丙基,分为正丙基和异丙基;
(4)同位素是质子数相同,中子数不同的原子;同系物是结构相似,在分子组成上相差一个或若干个CH2原子团的化合物.
解答 解:(1) ,只存在单键,应为烷烃,主链为5个碳,在2号碳上含有1个甲基,正确命名为2-甲基戊烷,烷烃分子中相邻碳原子上均带2个氢原子的碳原子间是对应炔存在C≡C的位置,即如图可以存在于4、5号之间和3、4号碳之间,共有2种结构,
,只存在单键,应为烷烃,主链为5个碳,在2号碳上含有1个甲基,正确命名为2-甲基戊烷,烷烃分子中相邻碳原子上均带2个氢原子的碳原子间是对应炔存在C≡C的位置,即如图可以存在于4、5号之间和3、4号碳之间,共有2种结构,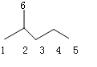 故答案为:2-甲基戊烷,2;
故答案为:2-甲基戊烷,2;
(2)分子式为C4H10O属于醇类的有机物,即羟基取代H原子的位置,已知丁基有4种,故此醇类有4种,C4H9OH中,能被氧化生成醛,说明与羟基相连的碳上有2个氢原子,丁基-C4H9可能的结构有:-CH2CH2CH2CH3、-CH(CH3)CH2CH3、-CH2CH(CH3)2、-C(CH3)3,其中与羟基相连的碳上有2个氢原子的是:-CH2CH2CH2CH3、-CH2CH(CH3)2,所以该有机物的可能结构有2种,故答案为:4;2;
(3)丙烷失去1个H的基团为丙基,正丙基的结构简式为CH3CH2CH2-,异丙基结构简式为:(CH3)2CH-,故答案为:(CH3)2CH-;
(4)A、O2和O3 为同种元素形成的不同种单质,互为同素异形体;
B、612C和613C,质子数相同,质子数不同,互为同位素;
C.CH3CH2CH2CH3和CH3CH(CH3)CH2CH3,结构相似,分子组成上相差1个CH2原子团属于同系物;
D.CH3CH2CH(C2H5)CH3和CH3CH2CH2CH(CH3)CH2CH3,结构相似,分子组成上相差1个CH2原子团属于同系物;
E. 和
和 ,甲烷为正四面体结构,故其二氟取代物不存在同分异构体,两者属于同种物质;
,甲烷为正四面体结构,故其二氟取代物不存在同分异构体,两者属于同种物质;
F. 和
和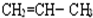 二者,结构相似,分子组成上相差1个CH2原子团,属于同系物;
二者,结构相似,分子组成上相差1个CH2原子团,属于同系物;
G.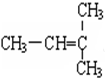 和
和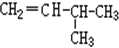 ,;两者分子式相同,结构不同,属于同分异构体,故答案为:B;C、D、F.
,;两者分子式相同,结构不同,属于同分异构体,故答案为:B;C、D、F.
点评 本题主要考查的是烷烃的命名,同分异构体的判断以及同位素,同分异构体等概念的辨析,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液与铜粉反应:Cu+Fe3+═Fe2++Cu2+ | |
| B. | 稀HNO3与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ | |
| D. | 碳酸氢钙与盐酸反应:HCO${\;}_{3}^{-}$+H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 C2H4 C3H4 | B. | CH4 C2H6 C2H2 | C. | C2H2 C2H4 C3H4 | D. | C2H2C3H6 C4H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用HA溶液做导电实验,灯泡很暗 | |
| B. | HA和CaCO3发生反应放出CO2 | |
| C. | pH=2的HA溶液稀释至100倍,pH小于4 | |
| D. | pH=3的HA溶液中水电离出的c(H+)为10-11mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
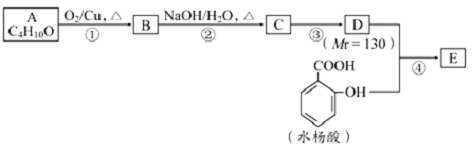
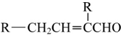 ;
; 、-CHO;③的反应类型为加成反应(或还原反应).
、-CHO;③的反应类型为加成反应(或还原反应).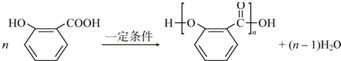 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子在反应中得到的电子数比Y原子在反应中得到的电子数少 | |
| B. | 气态氢化物 Y比X稳定 | |
| C. | X的最高正价比Y的最高正价高 | |
| D. | X单质能与Y的氢化物反应生成Y单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
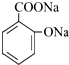
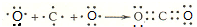 .
.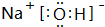 ,其中存在的化学键有离子键、共价键.
,其中存在的化学键有离子键、共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com