
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为 , 原子个数比为 , 分子的物质的量之比为 .
(2)等温等压下,等体积的O2和O3所含分子个数比为 , 原子个数比为 , 质量比为 .
(3)设NA为阿伏伽德罗常数的数值,如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积约是 (用含NA的式子表示).
【答案】
(1)3:2,1:1,3:2
(2)1:1,2:3,2:3
(3)![]()
【解析】解:(1)假设O2和O3的质量均为48g,
则O2的物质的量为 ![]() =1.5mol,
=1.5mol,
O3的物质的量为 ![]() =1mol,
=1mol,
故O2和O3所含分子个数比为1.5mol:1mol=3:2;
O2和O3均由O原子构成,则氧原子质量相等,含有O原子数目相等,即原子个数比为1:1,
O2和O3分子的物质的量之比为1.5mol:1mol=3:2,
所以答案是:3:2;1:1;3:2;
(2)温同压下,气体摩尔体积相同,根据N= ![]() 知,等体积的O2和O3所含分子个数比是1:1,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以原子个数之比是2:3,根据m=
知,等体积的O2和O3所含分子个数比是1:1,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以原子个数之比是2:3,根据m= ![]() M知,其质量之比等于其摩尔质量之比=32g/mol:48g/mol=2:3;
M知,其质量之比等于其摩尔质量之比=32g/mol:48g/mol=2:3;
所以答案是:1:1;2:3;2:3;
(3)根据其组分都为氧气相同,所以其质量与分子数成正比,ag氧气含有的分子数为:b个,质量与分子数的比列式为:ag:b个=cg:x个,
x= ![]() 个;
个;
cg该混合气体含有的物质的量为:n= ![]() =mol其体积为:V=n×Vm =
=mol其体积为:V=n×Vm = ![]() mol×Vm =
mol×Vm = ![]() L.
L.
所以答案是: ![]() L.
L.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定条件下:甲分子和乙分子反应生成丙分子和丁分子,下列说法不正确的是( ) 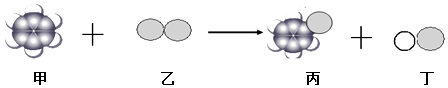
A.分离甲和丙可以采用蒸馏法
B.甲的空间构型是平面正六边形
C.丙不属于烃类物质
D.该反应类型是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生如下反应:3A+B2C (A、B、C均为气体),若最初加入的A、B都是4mol,10s内用A表示的平均反应速率为0.12mol/(Ls),则10s后容器中的B的物质的量是( )
A.2.8 mol
B.1.6 mol
C.3.2 mol
D.3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液导电能力越强,电导率越大。常温下用0.1000 mol/L 盐酸分别滴定10.00 mL浓度均为0.1000 mol/L的NaOH溶液和二甲胺[ (CH3)2NH]溶液( 二甲胺在水中电离与氨相似,已知在常温下Kb[(CH3)2NH·H2O] =1.6×10-4),利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
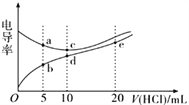
A. 盐酸滴定二甲胺实验中选择酚酞做指示剂比选甲基橙误差更小
B. d点溶液中:c(H+)<c(OH-)+c[(CH3)2NH2+]
C. a 点溶液与d点的溶液混合后的溶液中:c[(CH3)2NH2+]<c[(CH3)2NH·H2O]
D. b、c、e.三点的溶液中,水的电离程度最大的是e点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和.
(1)C离子的结构示意图为 . D在周期表中位置.
(2)A、D两元素形成的化合物属(填“离子”或“共价”)化合物.
(3)写出E的电子式: .
(4)写出D的最高价氧化物的水化物和A反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔盐的化学式为( NH4)2Fe(SO4)2·6H2O,溶于水而不溶于乙醇,常被用作氧化还原滴定的基准物。下面是制取莫尔盐的部分装置与实验步骤:

①将铁屑放入小烧杯中,加适量的Na2CO3溶液,小火加热几分钟,倒掉溶液后,用蒸馏水洗净铁屑,晾干。
②在锥形瓶中加入2.24 g 铁屑和少量碳粉,由分液漏斗滴加20 mL 3 mol/L硫酸溶液。
③待反应结束后,由分液漏斗加入适量的(NH4)2SO4溶液,过滤。在滤液中加入一定量的乙醇,待晶体析出后,过滤、洗涤、晾干,得莫尔盐晶体。
请回答下列问题:
(1)实验开始前,检查反应器气密性的方法为_____________________。
(2)步骤①中Na2CO3溶液的作用是_____________________________________。
(3)步骤②中滴加硫酸溶液时留取少许溶液于分液漏斗中的原因是__________________,加入少量碳粉的作用是_________________________________________。
(4)步骤③中理论上需加入2 mol/L 的(NH4)2SO4溶液______________mL。
(5)取10.00 g铬青铜样品,将其中的铬氧化为H2CrO4,再加入硫酸酸化,并配成250mL溶液,取出25.00 mL用浓度为0.0180 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,终点时用去标准液20.75 mL。已知弱酸H2CrO4被还原为Cr3+,则滴定时反应的离子方程式为_____________________________________。该样品中铬元素的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X和Y的离子X2+和Y2-具有相同的电子层结构,则下列说法正确的是
A. X2+的离子半径比Y2-小 B. X2+的原子序数比Y2-小
C. X和Y原子的电子层数相等 D. X和Y原子最外层电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①101kPa时,C(s)+ ![]() O2(g)=CO(g)△H1=﹣110.5kJmol﹣1②稀溶液中,H+(aq)+OH﹣(aq)=H2O(l)△H2=﹣57.3kJmol﹣1下列结论正确的是( )
O2(g)=CO(g)△H1=﹣110.5kJmol﹣1②稀溶液中,H+(aq)+OH﹣(aq)=H2O(l)△H2=﹣57.3kJmol﹣1下列结论正确的是( )
A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.浓硫酸与稀NaOH溶液反应的中和热为﹣57.3 kJmol﹣1
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下两个反应: (A)NaOH+HCl═NaCl+H2O
(B)2FeCl3+Fe═3FeCl2
①根据两反应本质,分别判断能否用于设计原电池 .
②如果不能,说明其原因 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com