
【题目】CO2、CO可与H2在一定条件下反应合成二甲醚(CH3OCH3)、甲醇(CH3OH)、草酸(H2C2O4)等化工原料。
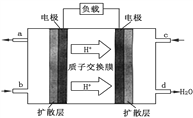
(1)二甲醚可作为绿色环保型能源。二甲醚空气燃料电池的工作原理如图所示。该电池工作时,c通入的物质为______________ ,该电极的电极反应式为_______________。
(2)某同学用甲醇和其它试剂组装了如下图所示装置,来研究有关电化学问题(甲、乙、丙三池中电解质足量)。当闭合该装置的电键K时,观察到电流计的指针发生了偏转。
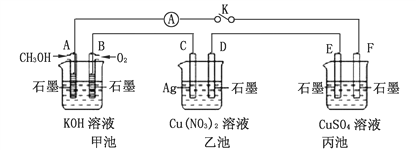
①丙池中F电极为____________(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应化学方程式为_______________;
②若丙池溶液的体积为500 mL,当乙池中C极质量减轻5.4g时,丙池溶液的pH为_______(忽略溶液体积的变化);
③一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是______ (填序号)。
A. Cu B. CuO C. Cu(OH)2 D. Cu2(OH)2CO3
(3)已知:常温下,H2C2O4的电离常数分别是Ka1≈5.0×10-2,Ka2≈6.0×l0-5。草酸的钾盐有K2C2O4、KHC2O4。常温下,KHC2O4的水解常数Kh2=___________,KHC2O4溶液的pH______7(填“﹥”、“﹤”或“=”)。
【答案】 O2或空气 O2+4H++4e- === 2H2O 阴极 2CuSO4+2H2O![]() 2H2SO4+2Cu+O2↑ 1 A 2.0×10-13 <
2H2SO4+2Cu+O2↑ 1 A 2.0×10-13 <
【解析】(1)本题考查燃料电池,以及电极反应式的书写,根据原电池的工作原理,电解质的阳离子向正极移动,即电池右端为正极,左端为负极,即c通入的物质为O2或空气,根据电池的工作原理,因此正极反应式为O2+4H++4e-=2H2O;(2)考查原电池和电解池的综合应用,①甲池为燃料电池,乙池、丙池为电解池,甲池中通氧气一极为正极,即B为正极,A为负极,F电极连接A,即F为阴极,该池电解硫酸铜溶液,总电极反应方程式为2CuSO4+2H2O![]() 2H2SO4+2Cu+O2↑;②C极反应式为Ag-e-=Ag+,丙池中E电极反应式为2H2O-4e-=4H++O2↑,串联电路中通过的电量是相同的,因此关系式有4Ag~4e-~4H+,n(H+)=5.4/108mol=0.05mol,c(H+)=0.05/500×10-3mol·L-1=0.1mol·L-1,即溶液的pH=1;③乙池中总电极反应方程式为2Ag+Cu2+
2H2SO4+2Cu+O2↑;②C极反应式为Ag-e-=Ag+,丙池中E电极反应式为2H2O-4e-=4H++O2↑,串联电路中通过的电量是相同的,因此关系式有4Ag~4e-~4H+,n(H+)=5.4/108mol=0.05mol,c(H+)=0.05/500×10-3mol·L-1=0.1mol·L-1,即溶液的pH=1;③乙池中总电极反应方程式为2Ag+Cu2+![]() 2Ag++Cu,因此恢复到反应前的浓度,需要加入铜单质,故选项A正确;(3)本题考查三大平衡常数的应用,Kh2=
2Ag++Cu,因此恢复到反应前的浓度,需要加入铜单质,故选项A正确;(3)本题考查三大平衡常数的应用,Kh2=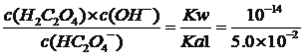 =2×10-13<6.0×10-5,说明HC2O4-的电离程度大于其水解,溶液显酸性,即KHC2O4溶液的pH<7。
=2×10-13<6.0×10-5,说明HC2O4-的电离程度大于其水解,溶液显酸性,即KHC2O4溶液的pH<7。


科目:高中化学 来源: 题型:
【题目】某兴趣小组以重铬酸钾(K2Cr2O7)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。
已知:①K2Cr2O7溶液存在平衡:Cr2O![]() +H2O
+H2O![]() 2CrO
2CrO![]() +2H+。
+2H+。
②含铬元素的离子在溶液中的颜色:Cr2O![]() (橙色);CrO
(橙色);CrO![]() (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。

(1)i可证明反应Cr2O![]() +H2O
+H2O![]() 2CrO
2CrO![]() +2H+的正反应是__________(填“吸热”或“放热”)。
+2H+的正反应是__________(填“吸热”或“放热”)。
(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_________。
(3)iii的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的________(填“能”或“不能”),理由是____________。
(4)根据实验Ⅱ中不同现象,可以得出的结论是__________。
(5)继续实验

①解释溶液变黄的主要原因是________。
②溶液变绿色,该反应的离子方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某镍冶炼车间排放的漂洗废水中含有一定浓度的Ni2+和Cl-,图甲是双膜三室电沉积法回收废水中Ni2+的示意图,图乙描述的是实验中阴极液pH与镍回收率之间的关系。下列说法不正确的是

A. 交换膜b为阴离子交换膜
B. 阳极反应式为2H2O-4e-=O2↑+4H+
C. 阴极液pH= 1时,镍的回收率低主要是有较多H2生成
D. 浓缩室得到1L 0.5 mol/L盐酸时,阴极回收得到11.8 g镍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份100mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸体积之间的关系如图所示。下列说法正确的是
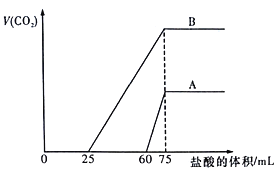
A. B曲线中消耗盐酸0<V(HCl)<25mL时发生的离子反应为: OH-+H+=H2O,H++CO32-=HCO3-
B. 原NaOH溶液的物质的量浓度为0.75mol/L
C. B曲线最终产生的CO2体积(标准状况下)为112mL
D. 加盐酸之前A溶液中的溶质是碳酸钠和碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )

A. a~b点导电能力增强说明HR为弱酸
B. a、b点所示溶液中水的电离程度不相同
C. b恰好完全中和,pH=7说明NH4R没有水解
D. c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的前四周期元素,A是原子半径最小的元素,B元素有两个未成对电子,D元素的最外层电子是内层电子数的三倍,E的单质是自然界中最硬的金属,常用于制作合金,且其未成对电子数在同周期中最多。回答下列问题:
(1)利用原子发生跃迁时吸收或释放出的光用于鉴定E元素,该方法是________,其价层电子排布图为____________,根据_____________原理,该基态原子的电子排布应使其能量处于最低状态。
(2)根据电子排布,C元素处于周期表中_______区;根据元素周期律,电负性B_______C,第一电离能C________D(填“大于”、“小于”或者“等于”)。
(3)化合物A2D分子空间构型是_____________;A与C以原子个数比2:1形成的分子中C原子的杂化方式为_________,它是_________分子(填“极性”或“非极性”),且该分子可以与很多金属离子形成配合物,其中提供孤对电子的原子是____________(填元素符号)。
(4)生活中常见的B元素的同素异形体有两种,其结构为图1、图2所示:
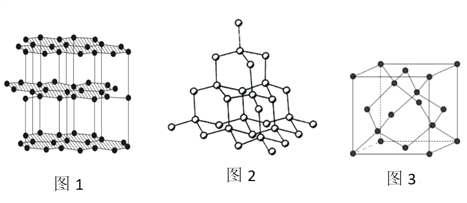
①图1所对应的同素异形体可以导电,试从其结构予以解释_________。
②图2所对应的同素异形体的晶胞如图3,若B原子的半径为a nm,则该晶胞的空间利用率为_____________。(![]() =1.732,结果保留一位小数)
=1.732,结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代传感技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验 (装置如图1所示),并用中和滴定实验测定所得氨水的浓度。
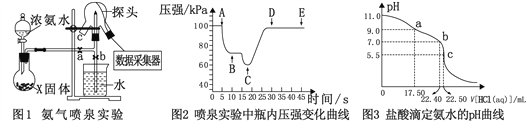
Ⅰ. 用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1)。
(1)制取氨气。烧瓶中X固体可以是_______________。
(2)关闭a,将吸有2 mL水的胶头滴管塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内气压变化曲线(图2)。则AB段压强变化的原因是__________。
Ⅱ. 室温下,用盐酸滴定得到的氨水,测定氨水的浓度。
(3)从三颈瓶中用______________(填仪器名称)量取25.00 mL氨水至锥形瓶中,用0.050 mol·L-1 盐酸滴定。用pH计采集数据、电脑绘制滴定曲线(图3)。则:
①该滴定的终点为_____________(填“a”、“b”或“c”);
②b点对应的溶液中,c(NH4+) _______ c(Cl-) (填“>”、“<”或“=”);
③据图,计算氨水的浓度为___________。
(4)该滴定实验中,若酸式滴定管未用盐酸润洗会导致测得氨水的浓度____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为两种金属组成的合金,发生如下图所示的变化:

试填写以下空白:
(1)合金A由________和________组成。
(2)写出下列变化的离子方程式。
C→E______________________________________________________________;
D→F______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )

A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com