
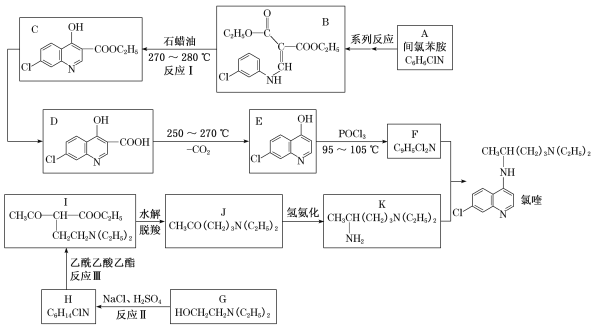
����Ŀ��������������¹ڷ�����һ����Ч���������������������Ʊ����������ɼ��ȱ����ϳ���୵�һ�ֺϳ�·�ߣ�
�ش��������⣺
��1����֪��ӦI��B��C+X���Ʋ�X��������______��D�к��������ŵ�������____��
��2��F�Ľṹ��ʽΪ_______________����ӦII�ķ�Ӧ������___________��
��3����ӦIII�Ļ�ѧ����ʽΪ____________��
��4��������M(C7H8ClN)��A��ͬϵ���ijЩͬ���칹��ĺ˴Ź���������4��壬�������Ϊ1:1:1:1�����ϸ�Ҫ���ͬ���칹����_________�֡�
��5��������Ȼ��S��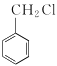 ����������������Ϊԭ���Ʊ�
����������������Ϊԭ���Ʊ�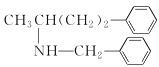 �ĺϳ�·�ߣ����Լ���ѡ��________��
�ĺϳ�·�ߣ����Լ���ѡ��________��
���𰸡��Ҵ� �ǻ����Ȼ�  ȡ����Ӧ C1CH2CH2N(C2H5)2+CH3COCH2COOC2H5��HC1+
ȡ����Ӧ C1CH2CH2N(C2H5)2+CH3COCH2COOC2H5��HC1+![]() 2
2 
��������
������ϳ�·�ߣ���Ϸ�Ӧ�������Ļ�ѧʽ��ṹ��ʽ�IJ����Լ���Ӧ���������ƶϡ�������A�Ļ�ѧʽ��������֪A�Ľṹ��ʽΪ ��A��һϵ�з�Ӧ��������B����������B��C�Ľṹ��ʽ���ݴ˿ɵ�֪��Ӧ�����һ����Ļ�ѧʽ������C��D�Ľṹ��ʽ���죬��֪C��D�Ĺ����з�����������ˮ�ⷴӦ������D��250��270�������ȣ���������E����E��F�Ļ�ѧʽ����֪E��F������ȡ����Ӧ����ԭ��ȡ�����ǻ����ɴ˿�֪F�Ľṹ��ʽΪ
��A��һϵ�з�Ӧ��������B����������B��C�Ľṹ��ʽ���ݴ˿ɵ�֪��Ӧ�����һ����Ļ�ѧʽ������C��D�Ľṹ��ʽ���죬��֪C��D�Ĺ����з�����������ˮ�ⷴӦ������D��250��270�������ȣ���������E����E��F�Ļ�ѧʽ����֪E��F������ȡ����Ӧ����ԭ��ȡ�����ǻ����ɴ˿�֪F�Ľṹ��ʽΪ ��
��
����G��H�Ļ�ѧʽ�IJ��죬��֪G�е��ǻ�Ҳ��Clԭ��ȡ����������ȡ����Ӧ������H�Ļ�ѧʽ��I�Ľṹ��ʽ����֪�������������Ľṹ��ʽ��������д����Ӧ��Ļ�ѧ��Ӧ����ʽ��I��J��K�ķ�Ӧ���̺����ʵĽṹ��ʽ���Ѹ�������F��K��Ӧ������୵ķ�Ӧ����ʽҲ���������Ϣд����
��1������B��C�Ļ�ѧʽ������֪��Ӧ�����һ���ﻯѧʽΪC2H6O����������B�е�ԭ�����ӷ�ʽ����֪������Ϊ�Ҵ���D�к���������Ϊ�ǻ����Ȼ�����Ϊ���Ҵ����ǻ����Ȼ���
��2����E(C9H6OClN)��F(C9H5Cl2N)�Ļ�ѧʽ����֪E�е��ǻ�����ԭ��ȡ������F�Ľṹ��ʽΪ�� ����Ӧ��Ҳ��G�е��ǻ�����ԭ��ȡ����Ϊȡ����Ӧ����Ϊ��
����Ӧ��Ҳ��G�е��ǻ�����ԭ��ȡ����Ϊȡ����Ӧ����Ϊ�� ��ȡ����Ӧ��
��ȡ����Ӧ��
��3����H��ClCH2CH2N(C2H5)2�ݺ�I�Ľṹ��ʽ����֪���������������Ľṹ��ʽΪCH3COCH2COOC2H5���ɴ˿�֪��Ӧ��Ļ�ѧ����ʽΪ��C1CH2CH2N(C2H5)2+CH3COCH2COOC2H5��HC1+![]() ����Ϊ��C1CH2CH2N(C2H5)2+CH3COCH2COOC2H5��HC1+
������C1CH2CH2N(C2H5)2+CH3COCH2COOC2H5��HC1+![]() ��
��
��4��������M(C7H8ClN)��A��ͬϵ���˴Ź���������4��壬�������Ϊ1:1:1:1��ͬ���칹��Ϊ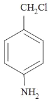 ��
��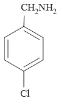 �����ϸ�Ҫ���ͬ���칹����2�֣���Ϊ��2��
�����ϸ�Ҫ���ͬ���칹����2�֣���Ϊ��2��
��5��������Ȼ��S��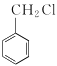 ����������������Ϊԭ���Ʊ�
����������������Ϊԭ���Ʊ� �ĺϳ�·�ߣ�����ת��ͼ�з�Ӧ���֪���Ȼ���������������������ȡ����Ӧ��Ȼ��ˮ�����ȡ��ⰱ�����γɰ����������Ȼ����е���ԭ�ӷ���ȡ����Ӧ�����ɵò���ϳ�·��Ϊ��
�ĺϳ�·�ߣ�����ת��ͼ�з�Ӧ���֪���Ȼ���������������������ȡ����Ӧ��Ȼ��ˮ�����ȡ��ⰱ�����γɰ����������Ȼ����е���ԭ�ӷ���ȡ����Ӧ�����ɵò���ϳ�·��Ϊ�� ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯������ͨ��һ����Ӧֱ����ɵ���
A. Al(OH)3 �� Al2O3 B. Al2O3 �� Al(OH)3
C. Al �� AlO2- D. Al3+ �� Al(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
���� | X | Y | Z |
��ʼŨ��/mol��L-1 | 0.1 | 0.2 | 0 |
ƽ��Ũ��/mol��L-1 | 0.05 | 0.05 | 0.1 |
����˵��������ǣ�
A. ��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50�� B. ��Ӧ�ɱ�ʾΪX+3Y![]() 2Z����ƽ�ⳣ��Ϊ1600 C. ����ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������ D. �ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
2Z����ƽ�ⳣ��Ϊ1600 C. ����ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������ D. �ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵؿ��к������Ľ���Ԫ�أ��䵥�ʺͻ�����㷺Ӧ�����ճ������С�������пհף�
��1����Ԫ�������ڱ��е�λ��Ϊ_____
��2�������õ�Ʒ��ڸ���Ʒ�ϵ������Ϊ�ⶨ�Ʋ��ȣ���NaOH��Һ�ܽ����Ʒ��������Ʋ㣬����Ӧת��6mol����ʱ��������������ʵ���Ϊ_____mol
��3��˫�ǻ���̼����[NaAl��OH��2CO3]��һ�ֳ��õĿ���ҩ������θ�ᷴӦ�Ļ�ѧ����ʽΪ_____
��4����ͼ�Ǵ���ʿ����Ҫ�ɷ�ΪAl2O3������������SiO2��Fe2O3�����ʣ�����ȡAl2O3������AlN�Ĺ������̣�
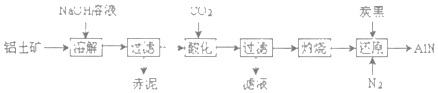
�����ܽ���ʱ��SiO2��NaOH��Һ��Ӧ���ɵĹ���������Һ��ƫ�����Ʒ�����Ӧ��2Na2SiO3+2NaAIO2+2H2O�TNa2Al2Si2O8��+4NaOH���������Ҫ�ɷ�Ϊ_____��д����ѧʽ����
�����ữ��ʱͨ�����CO2��NaAlO2��Ӧ����Al��OH��3��Һ����Ҫ�ɷ�Ϊ_____��д��ѧʽ����
������ԭ��ʱ��̿���ڸ����±�����ΪCO����Ӧ�Ļ�ѧ����ʽΪ_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ���ͬ��X��Y���ܱ�������X�г���CO���壬Y�г���CH4��O2��N2�Ļ�����壬ͬ��ͬѹ�²���������������ܶ���ͬ�����������в���ȷ����
A.Y������CH4��O2��N2������֮�ȿ���Ϊ1��6��3
B.Y������CH4��O2��N2�����ʵ���֮��һ��Ϊ1��3��6
C.���������������������һ����ͬ
D.���������������������һ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������![]() ����ͼ����һ����Ҫ�IJ����м��壬�����йػ�����
����ͼ����һ����Ҫ�IJ����м��壬�����йػ�����![]() ��˵������ȷ����
��˵������ȷ����
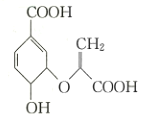
A.�����к������ֹ�����
B.�����Ҵ������ᷴӦ
C.����̼ԭ��һ������ͬһƽ��
D.��ʹ������Ȼ�̼��Һ�����Ը��������Һ��ɫ����ԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ƣ�![]() ����һ�ֽⶾҩ�������軯��顢����Ǧ���顢����ж����ٴ�����������ݡ���Ƥ�������Ȳ�֢����������������Ի���Ի������ȶ�����������Һ�зֽ����
����һ�ֽⶾҩ�������軯��顢����Ǧ���顢����ж����ٴ�����������ݡ���Ƥ�������Ȳ�֢����������������Ի���Ի������ȶ�����������Һ�зֽ����![]() ��
��![]() ��
��
ʵ���.![]() ���Ʊ�����ҵ�Ͽ��÷�Ӧ��
���Ʊ�����ҵ�Ͽ��÷�Ӧ��![]() �Ƶã�ʵ����ģ��ù�ҵ���̵�װ����ͼ��ʾ��
�Ƶã�ʵ����ģ��ù�ҵ���̵�װ����ͼ��ʾ��

(1)����a��������__________������b��������_____________��b��������������Ϊ70%~80%��![]() ��Һ��
��Һ��![]() ���巴Ӧ�Ʊ�
���巴Ӧ�Ʊ�![]() ��Ӧ�Ļ�ѧ����ʽΪ_______________________��c���Լ�Ϊ________��
��Ӧ�Ļ�ѧ����ʽΪ_______________________��c���Լ�Ϊ________��
(2)ʵ����Ҫ����![]() ���������ʣ����Բ�ȡ�Ĵ�ʩ��_________________________��д��һ������
���������ʣ����Բ�ȡ�Ĵ�ʩ��_________________________��д��һ������
(3)Ϊ�˱�֤��������ƵIJ�����ʵ����ͨ���![]() ���ܹ�����ԭ����_________________________��
���ܹ�����ԭ����_________________________��
ʵ���.̽��![]() ����������ӵ�������ԭ��Ӧ��
����������ӵ�������ԭ��Ӧ��
���ϣ�![]() ���Ϻ�ɫ��
���Ϻ�ɫ��
װ�� | �Լ�X | ʵ������ |
|
| ��Ϻ���Һ�ȱ���Ϻ�ɫ��30s����Һ������Ϊ��ɫ |
(4)��������ʵ���������ж�����![]() ��
��![]() ��ԭΪ
��ԭΪ![]() ��ͨ��________________________����������Լ���������һ��֤ʵ������
��ͨ��________________________����������Լ���������һ��֤ʵ������![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧԭ�����о��������ʼ�����ת�����������Ҫ�ĵļ�ֵ��
��1�����ϼ���ѧϰ������ԭ��Ӧ�Ļ�������������д�����¼�������������Ԫ���Ļ��ϼۡ�
NaI��____�� ClO3����____�� K2MnO4 ��___�� Br2��___��
��2��1774�꣬��仯ѧ���������о����̿���Ҫ�ɷ���MnO2���Ĺ����У�������Ũ�����ϼ��ȣ���������ɫ���壬��Ӧ����ʽΪ��MnO2��4HCl��Ũ��![]() MnCl2��Cl2����2H2O���ӷ�Ӧ������ѡһ�����ʣ�˵���䷢��������Ӧ������ԭ��Ӧ��������_______��
MnCl2��Cl2����2H2O���ӷ�Ӧ������ѡһ�����ʣ�˵���䷢��������Ӧ������ԭ��Ӧ��������_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ȼ��仯��������ѧ��ѧ��Ҫ����ɲ��֡�
��1������ȼ�ϵ��ʹ�õĵ������Һ��KOH��Һ����ط�ӦΪ��4NH3+3O2��2N2+6H2O���õ�ظ����ĵ缫��ӦʽΪ____���øõ�ؽ��д�ͭ����Al��Zn��Ag��Pt��Au�����ʣ��ĵ�⾫������CuSO4��ҺΪ�������Һ������˵����ȷ����____��
a������ȫ��ת��Ϊ��ѧ��
b��SO42�������ʵ���Ũ�Ȳ��䣨��������Һ����仯��
c����Һ��Cu2+�������ƶ�
d������������ɻ���Ag��Pt��Au�Ƚ���
e����������������64g����ת�Ƶ�����Ϊ2NA��
��2���ٽ�SO2ͨ�뵽BaCl2��Һ�У��������쳣�����������Եİ�ɫ������Ϊ̽���ð�ɫ�����ijɷ֣������������ʵ�����̣���������Һ![]() ��ɫ����
��ɫ����![]() �۲������жϣ����Լ�A�Ļ�ѧʽΪ_____��ʵ������������Լ�A��ɫ����δ���ܽ⣬�����ð�ɫ���������ӷ���ʽ��____��
�۲������жϣ����Լ�A�Ļ�ѧʽΪ_____��ʵ������������Լ�A��ɫ����δ���ܽ⣬�����ð�ɫ���������ӷ���ʽ��____��
��������ͼ��ʾ�绯ѧװ�����չ�ҵβ����SO2������������Cu��д��װ���������ĵ缫��Ӧʽ_____��

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com