
分析 (1)由2Al+Fe2O3═2Fe+Al2O3,所以该铝热剂中铝的质量分数为$\frac{2×27}{2×27+160}×100%$=25.2%;
(2)8.1g铝粉的物质的量为:0.3mol,而16g氧化铁的物质的量为:0.1mol,由2Al+Fe2O3═2Fe+Al2O3反应方程式可知,铝过量,根据铁守恒可知,铁的物质的量为:0.1×2mol=0.2mol,结合m=nM计算;将反应后的固体混合物加入足量的稀盐酸中,反应过程中过量的铝为:0.3-0.2=0.1mol,根据得失电子守恒得:氢气的物质的量为:$\frac{0.1×3+0.2×2}{2}$=0.35mol;
(3)铝热剂中铝的物质为xmol,氧化铁的物质的量为ymol,由质量和氯守恒得$\left\{\begin{array}{l}{27x+160y=23.52g}\\{3x+4y=(5-0.2)×0.2mol}\end{array}\right.$,解之得$\left\{\begin{array}{l}{x=0.16mol}\\{y=0.12mol}\end{array}\right.$;
(4)铝和氢氧化钠溶液反应生成n(H2)=$\frac{672mL×1{0}^{-3}L/mL}{22.4L/mol}$=0.15mol,4mol/L的NaOH溶液,当加至30mL氢氧化钠的物质的量为:0.12mol,根据2Al+2NaOH+2H2O=2NaAlO2+3H2↑的关系式知,所以铝的物质的量为:0.1mol,氢氧化钠过量,所以铝热剂的总质量为:0.1mol×27g/mol+7.2g=9.9g,计算原铝热剂中氧化铁的质量分数为$\frac{7.2}{9.9}×100%$=74.8%.
解答 解:(1)由2Al+Fe2O3═2Fe+Al2O3,所以该铝热剂中铝的质量分数为$\frac{2×27}{2×27+160}×100%$=25.2%,故答案为:0.252或25.2%;
(2)8.1g铝粉的物质的量为:0.3mol,而16g氧化铁的物质的量为:0.1mol,由2Al+Fe2O3═2Fe+Al2O3反应方程式可知,铝过量,根据铁守恒可知,铁的物质的量为:0.1×2mol=0.2mol,结合m=nM=0.2×56=11.2g;将反应后的固体混合物加入足量的稀盐酸中,反应过程中过量的铝为:0.3-0.2=0.1mol,根据得失电子守恒得:氢气的物质的量为:$\frac{0.1×3+0.2×2}{2}$=0.35mol,故答案为:11.2;0.35;
(3)铝热剂中铝的物质为xmol,氧化铁的物质的量为ymol,由$\left\{\begin{array}{l}{27x+160y=23.52g}\\{3x+4y=(5-0.2)×0.2mol}\end{array}\right.$,解之得$\left\{\begin{array}{l}{x=0.16mol}\\{y=0.12mol}\end{array}\right.$,答:铝热剂中铝粉与氧化铁的物质的量分别是Al 0.16mol和Fe2O3 0.12mol;
(4)铝和氢氧化钠溶液反应生成n(H2)=$\frac{672mL×1{0}^{-3}L/mL}{22.4L/mol}$=0.3mol,4mol/L的NaOH溶液,当加至30mL氢氧化钠的物质的量为:0.12mol,根据2Al+2NaOH+2H2O=2NaAlO2+3H2↑的关系式知,所以铝的物质的量为:0.1mol,氢氧化钠过量,所以铝热剂的总质量为:0.1mol×27g/mol+7.2g=9.9g,计算原铝热剂中氧化铁的质量分数为$\frac{7.2}{9.9}×100%$=74.8%,答:铝热剂中氧化铁的质量分数为0.748或74.8%.
点评 本题考查了根据方程式进行计算,(1)中要进行过量计算,然后根据氢气的体积计算铝的质量,注意铝热剂中铝的质量为①中铝质量的2倍,为易错点;(2)中要根据电荷守恒、原子守恒、转移电子守恒进行解答,注意守恒思想的正确运用,难度中等.


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:选择题
| A. | 锌片溶解了1mol,铜片上析出1mol氢气 | |
| B. | 两极上溶解和析出的物质的质量相等 | |
| C. | 锌片溶解了1g,铜片上析出1g氢气 | |
| D. | 电解质溶液pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 6mol | B. | 4.7mol | C. | 3mol | D. | 2.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制造人民币所用的棉花、优质针叶木等原料含有C、H、O元素 | |
| B. | 用于人民币票面文字等处的油墨中所含有的Fe3O4是一种磁性物质 | |
| C. | 防伪荧光油墨由颜料与树脂等制成,其中树脂属于有机高分子材料 | |
| D. | 某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=3.36时,CO2+2OH-→CO32-+H2O | |
| B. | a=4.48时,2CO2+3OH-→CO32-+HCO3-+H2O | |
| C. | a=5.60时,3CO2+4OH-→CO32-+2HCO3-+H2O | |
| D. | a=6.72时,CO2+OH-→HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种无毒的气体均为还原产物 | |
| B. | 反应后溶液的pH会升高 | |
| C. | 氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 每转移2NA个电子时,一定会生成13.44 L的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2S全部溶于水所得溶液中HS-和S2-离子数之和为NA | |
| B. | 含4mol HCl的浓盐酸与足量二氧化锰反应转移的电子总数为2NA | |
| C. | 11g T2O含有的电子数为5NA | |
| D. | 常温下,0.2L 0.5mol/L NH4NO3溶液的氮原子数小于0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
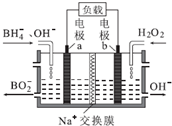
| A. | 电池的正极反应为H2O2+2e-=2OH- | |
| B. | 电池放电时Na+从a极区移向b极区 | |
| C. | 电子从电极b经外电路流向电极a | |
| D. | b极室的输出液经处理后可输入a极室循环利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com