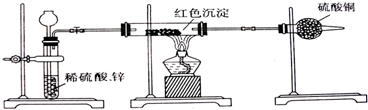
复分解反应存在这样一个规律:较强酸可制取较弱酸.中和反应、盐类的水解也是复分解反应,盐类的水解反应的逆反应是中和反应.盐类的水解反应中,弱酸强碱盐中弱酸根离子对应的弱酸越弱,其盐越容易发生水解.
已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
8.1 |
11.6 |
10.3 |
11.1 |
11.3 |
(1)请根据上述信息判断下列反应不能发生的是
AD
AD
(填编号).
A.CO
2+H
2O+2NaClO═Na
2CO
3+2HClO
B.CO
2+H
2O+NaClO═NaHCO
3+HClO
C.CO
2+H
2O+C
6H
5ONa-→NaHCO
3+C
6H
5OH
D.CO
2+H
2O+2C
6H
5ONa-→Na
2CO
3+2C
6H
5OH
E.Na
2CO
3+C
6H
5OH-→NaHCO
3+C
6H
5ONa
F.CH
3COOH+NaCN═CH
3COONa+HCN
(2)一些复分解反应的发生还遵循其他的规律.下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KCl和NaNO
3的混合溶液,首先析出NaCl晶体.
根据上述反应,总结出复分解反应发生的另一规律为
反应能够由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行
反应能够由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行
.
(3)物质的量浓度均为0.05mol/L的下列五种物质的溶液中,pH由大到小的顺序是
①④②③⑤
①④②③⑤
(填编号).
①C
6H
5OH(苯酚) ②CH
3COOH ③HClO
4 ④HClO ⑤H
2SO
4(4)一定温度下,向等体积纯水中分别加入等物质的量的下列物质:①NaOH、②CH
3COOH、③NaClO,则水的电离程度最大的是
③
③
(填编号).
(5)25℃时,M酸溶液的pH=a,N碱溶液的pH=b.
①若X为强酸,Y为强碱,且a+b=14,若两者等体积混合后,溶液的pH=
7
7
,此时溶液中金属阳离子浓度大于酸根阴离子浓度,其原因可能是
酸为二元强酸,碱为一元强碱
酸为二元强酸,碱为一元强碱
.
②若X的化学式为HR,Y的化学式为MOH,且a+b=14,两者等体积混合后溶液显酸性,则混合溶液中必定有一种离子能发生水解,该离子为
R-
R-
(填离子符号);混合后的溶液中,下列微粒浓度大小关系正确的是
c e
c e
(填序号).
a c(MOH)>c(M
+)>c(R
-)>c(H
+)>c(OH
-)
b c(HR)>c(M
+)>c(R
-)>c(OH
-)>c(H
+)
c c(R
-)>c(M
+)>c(H
+)>c(OH
-)
d c(M
+)>c(R
-)>c(OH
-)>c(H
+)
e c(M
+)+c(H
+)=c(R
-)+c(OH
-)

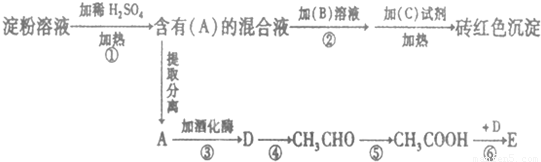
 ,反应⑥为乙酸与乙醇发生酯化反应,该反应为
,反应⑥为乙酸与乙醇发生酯化反应,该反应为 ,
,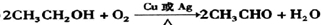 、氧化反应;
、氧化反应; 、酯化反应(或取代反应).
、酯化反应(或取代反应).