
| A、混合前0.2 mol?L-1 HA中:c(H+)=c(OH-)+c(A-) |
| B、混合后溶液中:c(Na+)+c(H+)=c(A-)+c(OH-) |
| C、混合后溶液中:c(Na+)>c(OH-)>c(A-)>c(H+) |
| D、混合后溶液中:c(A-)+c(HA)=c(Na+) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 实验操作 | 实验现象 | 结论 | |
| A | 淀粉与稀H2SO4共热,再加银 氨溶液水浴加热 | 无银镜生成 | 淀粉水解产物无还原性 |
| B | 向某溶液中先滴加氯水,再滴 加少量KSCN溶液 | 溶液变成血红色 | 溶液中含有Fe2+ |
| C | 向NaAlO2溶液中滴加饱和 NaHCO3溶液 | 有白色沉淀产生 | 验证两者都发生了水解反 应,且相互促进 |
| D | 将CO2通入Na2SiO3溶液中 | 有白色沉淀生成 | 证明H2CO3酸性比H2SiO3强 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2 878.0 |
| 乙烷 | 1 560.8 | 异丁烷 | 2 869.6 |
| 丙烷 | 2 221.5 | 2甲基丁烷 | 3 531.3 |
| A、热稳定性:正丁烷>异丁烷 |
| B、乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1 560.8 kJ/mol |
| C、正戊烷的燃烧热大于3 531.3 kJ/mol |
| D、相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 事 实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | NaHCO3溶液与Na[Al(OH)4]溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| C | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
| D | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
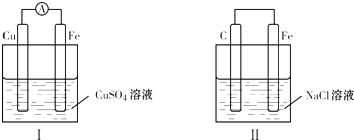
| A、装置Ⅰ:铁极会溶解,溶液从蓝色逐渐变成浅绿色 |
B、装置Ⅰ:电流方向由铁极→ →铜极 →铜极 |
| C、装置Ⅱ:碳极上有无色气体产生 |
| D、装置Ⅱ:铁极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaCl | AlCl3 | SiCl4 | 单质B | |
| 熔点 | 810℃ | 190℃ | -68℃ | 1300℃ |
| 沸点 | 1465℃ | 183℃ | 57℃ | 2500℃ |
| A、SiCl4形成的晶体是分子晶体 |
| B、单质B可能是原子晶体 |
| C、电解NaCl水溶液可制得金属钠 |
| D、不能用电解熔融AlCl3制取单质铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性 Mg(OH)2>Ca(OH)2 |
| B、酸性 H2SO4<H2CO3 |
| C、稳定性 H2S>H2Se |
| D、原子半径 S>P |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com