
| A. | CH4和NH4+ | B. | CO32-和NO3- | C. | CO和N2 | D. | H2O和CH4 |
分析 根据原子数相同、电子总数或价电子总数相同的分子,互称为等电子体,由此来解答.
解答 解:A、CH4分子中含有5个原子、10个电子,NH4+分子中含有5个原子、10个电子,属于等电子体,故A正确;
B、CO32-中含有4个原子、24个电子,NO3-分子中含有4个原子、24个电子,属于等电子体,故B正确;
C、CO分子中含有2个原子、14个电子,N2含有2个原子、14个电子,属于等电子体,故C正确;
D、H2O分子中含有3个原子、10个电子,CH4分子中含有5个原子、10个电子,不属于等电子体,故D错误;
故选D.
点评 本题考查了等电子体的判断,侧重于基本概念的考查,注意把握概念中的两个相等即可解题,题目比较简单.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
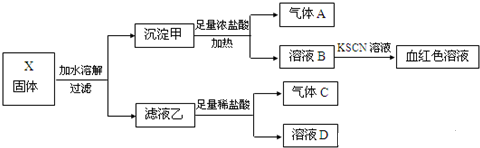
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M与R的质子数之和一定等于21 | B. | 若M在第3周期,则R一定在第2周期 | ||
| C. | M2-可能比R+的离子半径小 | D. | M与R的原子序数之差可能等于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
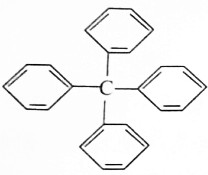 甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:
甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:| A. | 分子式为C25H20 | |
| B. | 所有碳原子都在同一平面上 | |
| C. | 此物质属于芳香烃类物质 | |
| D. | 该物质中既含有极性键又含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol•L-1) | c(H2SO4)/(mol•L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
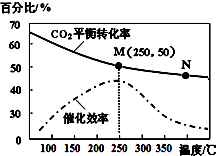 一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)有可能小于v(N) | |
| B. | 当温度高于250℃时,升高温度,平衡向逆反应方向移动,催化剂的催化效率降低 | |
| C. | 平衡常数:KM<KN | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点乙烯的体积分数为15.4% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com