
| A. | NH4Cl、HCl、H2O、H2 | B. | Cl2、Na2S、HCl、SO2 | ||
| C. | HBr、CO2、NH3、CS2 | D. | Na2O2、H2O2、H2O、O3 |
分析 根据化合物的类型和离子化合物中一定含有离子键,可能含有共价键,共价化合物中一定不含离子键,含有共价键分析判断.
解答 解:A、NH4Cl中含有离子键、HCl含有共价键、H2O含有共价键、H2含共价键,故A不符合;
B、Cl2含有共价键、Na2S含有离子键、HCl含有共价键、SO2含有共价键,故B不符合;
C、HBr、CO2、NH3、CS2分子中含的化学键都是共价键,故C符合;
D、Na2O2含有离子键和共价键、H2O2含有共价键、H2O含有共价键、O3含有共价键,故D不符合;
故选C.
点评 本题考查了根据化合物判断化学键类型,难度不大,明确离子键和共价键的区别是解答本题的关键.


科目:高中化学 来源: 题型:解答题
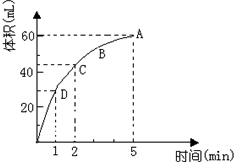 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示(假设溶液体积不变),回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示(假设溶液体积不变),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 陈述I | 陈述II |
| A | 酸性:HCl>H2CO3 | 非金属性:Cl>C |
| B | K+、Ca2+、Mg2+ 的离子半径依次减小 | K+、Ca2+、Mg2+氧化性性依次增强 |
| C | 硬铝是合金 | 其熔点比金属铝的熔点低 |
| D | 电镀时阳极上发生还原反应 | 可在铁的镀件上镀铜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4原子半径最大的是① | |
| B. | 具有下列最外层电子排布式的原子中,①3s23p1②3s23p2 ③3s23p3 ④3s23p4第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ | |
| D. | 某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(h) | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com