
����Ŀ��I����0.1 gMnO2��ĩ����50 mL H2O2��Һ�У��ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ��ʾ��
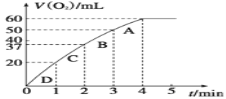
���ͷ�Ӧ���ʱ仯��ԭ��____________________________������H2O2�ij�ʼ���ʵ���Ũ��Ϊ_________��(������λ��Ч����)
���ͼ������������Ĵ������ʣ��ش��������⣺
(1) ���³�ѹ�£���ֱ̬��������̼ԭ������_________ ��
(2) ���ͼ����к�̼���ϸߵ���__________��
(3) ���������ʵ����ı��ͼ���ֱ�ȼ�գ��������ϴ����________________��
(4)д�������嵥�ʷ�Ӧ�Ļ�ѧ����ʽ __________________________________��
���𰸡����ŷ�Ӧ�Ľ��У�˫��ˮ��Ũ�ȼ��٣���Ӧ���ʼ��� 0.11mol/L 4 �� �� ![]()
��������
I.��ͬʱ������������Խ�࣬��Ӧ����Խ�죻��ͼ��֪������������Ϊ60mL����Ϸ�Ӧ��c=![]() ���㡣
���㡣
II.(1)���³�ѹ����ֱ̬��������̼ԭ������4��
(2)���������ʽ�жϺ�̼���ߵͣ�
(3)���顢��ȼ�����ɶ�����̼��ˮ�����ݷ���ʽ�ж���������������С��
(4)���廯�������������£�����Һ�巢��ȡ����Ӧ�����屽��HBr��
I.��ͬʱ������������Խ�࣬��Ӧ����Խ�죬�������20mL��17mL��13mL��10mL����Ӧ����ΪD��C��B��A����Ӧ���ʱ仯��ԭ�����������ŷ�Ӧ�Ľ��У�˫��ˮ��Ũ�ȼ��٣�Ũ��ԽС����Ӧ���ʼ�����
H2O2��ȫ��Ӧ�ų�60 mL O2��H2O2�ķֽⷴӦΪ2H2O2 ![]() 2H2O+O2������n(H2O2)=2
2H2O+O2������n(H2O2)=2![]() ��0.00536 mol����H2O2�ij�ʼ���ʵ���Ũ��Ϊ��c(H2O2)=
��0.00536 mol����H2O2�ij�ʼ���ʵ���Ũ��Ϊ��c(H2O2)=![]()
��0.11 mol/L��
II.(1)���³�ѹ����ֱ̬��������̼ԭ������4��
(2)���������ʽ�жϺ�̼���ߵͣ�����ķ���ʽ�����ʽ����CH4���������ʽΪCH���ɼ����к�̼���ߣ�
(3)����ȼ�����ɶ�����̼��ˮ����Ӧ����ʽΪ��CH4+2O2![]() CO2+2H2O����ȼ�շ���ʽΪ��C6H6+
CO2+2H2O����ȼ�շ���ʽΪ��C6H6+![]() O2
O2![]() 6CO2+3H2O�������ʵ����ı��ͼ���ֱ�ȼ�գ��������ϴ���DZ���
6CO2+3H2O�������ʵ����ı��ͼ���ֱ�ȼ�գ��������ϴ���DZ���
(4)���廯�������������£�����Һ�巢��ȡ����Ӧ�����屽��HBr����Ӧ����ʽΪ![]() ��
��


 ��������ϵ�д�
��������ϵ�д� ����˼ά����ѵ����ʱ��ѧ��ϵ�д�
����˼ά����ѵ����ʱ��ѧ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��������Ӽ������й��ۼ�����
A. KOH B. CaCl2 C. H2O D. NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£����һ�����ܱ������н������·�Ӧ��X(g)+Y(g) ![]() Z(g)+W(s), ��H>0����������ȷ������ ��
Z(g)+W(s), ��H>0����������ȷ������ ��
A. ��������W���淴Ӧ�ٶ����� B. ������������ѹǿ����ʱ����Ӧ�ﵽƽ��
C. �����¶ȣ�ƽ�������ƶ� D. ƽ������X��������Ӧ����H����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��R��T��X��Y��Z��Ԫ�����ڱ������λ�����±���ʾ�����ǵ�����������֮��Ϊ31���������ж���ȷ����
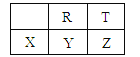
A��Rλ��Ԫ�����ڱ��еڶ����ڵ���A��
B��ԭ�Ӱ뾶��X��R��T
C�������̬�⻯���ȶ��ԣ�T��R��Y
D������������Ӧ��ˮ�������ԣ�T��R��Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ����( )
A. NaCl��Ħ��������58.5g
B. ��1Lˮ���ܽ�5.85gNaCl���������Ƶ�0.1mol/L��NaCl��Һ
C. ��״���£�22.4L H2O������ԭ�ӵ���ĿΪ2NA
D. 17g NH3�к��з�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������ľ̿�����������ҹ��Ĵ���֮һ�ĺڻ�ҩ�䷽���ڻ�ҩ��ըʱ�����ķ�ӦΪS+2KNO3+3C ![]() K2S+N2��+3CO2�������ڸ÷�Ӧ˵������ȷ����
K2S+N2��+3CO2�������ڸ÷�Ӧ˵������ȷ����
A. ����������CO2
B. ��ը��ԭ���Ƿ�Ӧ�ͷŴ����ȣ������ɴ�������
C. ��Ӧ��������Ԫ�صĻ��ϼ۷����仯
D. �������뻹ԭ�������ʵ���֮��Ϊ1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019����Ԫ�����ڱ�����150���꣬�ڼ��ѧ��Ϊ�������ڱ������˲�иŬ�����й���ѧԺԺʿ���������������ֲⶨ������49In����9��Ԫ�����ԭ����������ֵ��������Ϊ�����±�������﨣�37Rb��ͬ���ڡ�����˵������ȷ����
A. In�ǵ������ڵڢ�A��Ԫ��
B. 11549In����������������IJ�ֵΪ17
C. ԭ�Ӱ뾶��In>Al
D. ���ԣ�In(OH)3>RbOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA���������ӵ�������ֵ������˵����ȷ����
A. 0.5 molп�����������ᷴӦ����11.2 L H2 B. 0.1 mol CH4������ԭ����Ϊ0.4NA
C. ��״���£�11.2 L CCl4����������Ϊ0.5NA D. ���³�ѹ�£�28 g N2������ԭ�Ӹ���ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pH=1��ij��ҺX�н�����NH4+��Al3+��Ba2+��Fe2+��Fe3+��CO32����SO32����SO42����Cl����NO3���е�һ�ֻ��֣�����ˮ�ĵ��뼰���ӵ�ˮ�⣩��ȡ����Һ��������ʵ�飬ʵ�������ͼ�������й��ƶϲ���ȷ���ǣ�������
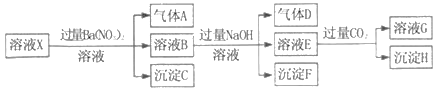
A. ��ҺX��һ������H+��Al3+��NH4+��Fe2+��SO42��
B. ������������ʵ�鲻��ȷ����ҺX���Ƿ���Fe3+��Cl��
C. ����HΪAl��OH��3��BaCO3�Ļ����
D. ����ҺXΪ100mL������������AΪ44.8mL����״��������X��c��Fe2+��=0.06molL��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com