
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
| A. | 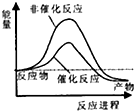 | B. | 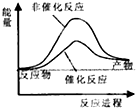 | C. | 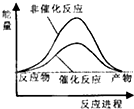 | D. | 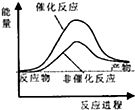 |
分析 根据△H=反应物的键能之和-生成物的键能之和,△H>0吸热,反应物的能量之和小于生成物的能量之和,△H<0放热,反应物的能量之和大于生成物的能量之和,据此分析.
解答 解:由CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=反应物的键能之和-生成物的键能之和=414×4+4×464-803×2-4×436=+162kJ/mol,所以该反应为吸热反应,则反应物的能量之和小于生成物的能量之和,又催化剂降低活化能使反应速率加快,则B正确;
故选:B.
点评 本题考查了化学反应能量变化分析,图象分析方法和应用,注意,△H>0吸热,反应物的能量之和小于生成物的能量之和,△H<0放热,反应物的能量之和大于生成物的能量之和,题目较简单.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+NaOH═CH3COONa+H2O | B. | HNO3+KOH═KNO3+H2O | ||
| C. | 3HCl+Fe(OH)3═FeCl3+3H2O | D. | 2HCl+Cu(OH)2═CuCl2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4是硫酸盐 | B. | NaHSO4是酸式盐 | C. | NaHSO4是钠盐 | D. | NaHSO4是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
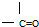 ②
②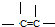 ③
③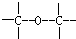 ④
④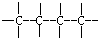
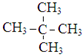
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液 | B. | NaOH溶液 | C. | KNO3溶液 | D. | AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知常温下AgCl的溶解度远大于AgBr,现将AgCl和AgBr的两种饱和溶液等体积混合后,再加入足量浓AgNO3溶液,生成的AgCl沉淀多于AgBr沉淀 | |
| B. | Fe(OH)3溶于氢碘酸的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | 甲基橙呈黄色的溶液中,I-、Cl-、NO3-、Na+一定可以大量共存 | |
| D. | 已知甲烷的燃烧热为890.3kJ•mol-1,则表示甲烷燃烧热的热化学方程式为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
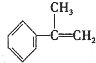 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式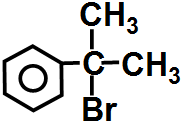 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com