
【题目】生产液晶显示器过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000-20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 |
|
|
|
键能 | 941.7 | 154.8 | 283.0 |
下列说法中正确的是( )
A. 反应中![]() 为吸热反应
为吸热反应
B. 过程![]() 放出能量
放出能量
C. 反应中![]() ,N2与F2的总能量小于NF3的总能量
,N2与F2的总能量小于NF3的总能量
D. NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
【答案】B
【解析】
化学键的断裂需要吸收能量,化学键的形成要放出能量,两个过程的总体热效应是反应热。若反应物键能之和小于生成物键能之和,则反应物的总能量高于生成物总能量,该反应为放热反应。
A项、反应物的键能之和为(941.7+3×154.8)kJmol-1=1406.1 kJmol-1,生成物键能之和为283.0×6KJmol-1=1698KJmol-1,反应物键能之和小于生成物键能之和,则反应物的总能量高于生成物总能量,该反应为放热反应,故A错误;
B项、N(g)+3F(g)→NF3(g)为化学键的形成过程,是一个放出能量的过程,故B正确;
C项、该反应为放热反应,反应物的总能量高于生成物总能量,则N2与F2的总能量大于NF3的总能量,故C错误;
D项、化学反应的实质就是旧键的断裂与新键的生成,如果没有化学键的断裂与生成,不可能发生化学反应,故D错误。
故选B。


科目:高中化学 来源: 题型:
【题目】将Mg条、Al条平行插入一定浓度的NaOH溶液中,用导线、电流计连接成原电池,此电池工作时,下列叙述中正确的是( )
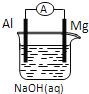
A. Mg比Al活泼,Mg 失去电子被氧化成Mg2+
B. 负极反应式为:Al+4OH--3e-=AlO2-+2H2O
C. 该电池的内外电路中,电流均是由电子定向移动形成的
D. 原电池工作过程中溶液PH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶性离子是大气颗粒物的主要成分,研究其化学组成对于治理大气污染其有重大意义,某地区大气颗粒物经采样与必要的预处理后得试样溶液。经离子色谱检验确定含有以下离子NH4+、Na+、Mg2+、Ca2+、Al3+、SO42-、NO3-、CO32-、Cl-。某同学对其再进行如下的实验:
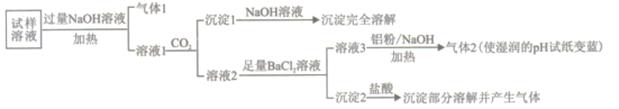
已知:在加热与强碱性条件下,铝单质可以将NO3-还原为氨气。
回答下列问题:
(1)“气体1“的电子式为_________。
(2)生成“沉淀1”的离子方程式为________。
(3)“沉定2”的成分是___________(填化学式)。
(4)“溶液3![]() 气体2”的离子方程式为_________。
气体2”的离子方程式为_________。
(5)根据上述实验可推断该地区大气颗粒物中__________含量较低(填离子符号)。
(6)已知大气颗粒物中各元素的行染主体如下表:
元素 | N | S | Na、Mg、Cl | Al | Ca |
污染主体 | 机动车尾气 | 燃煤污染 | 海盐离子 | 土壤扬尘 | 建筑粉尘 |
根据实验结果可判断该地区大气颗粒物污染主体有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种不同的物质中均含有同一种元素,它们之间存在如图所示的转化关系(部分反应物及生成物已略去).请回答下列问题:

(1)若常温时B为红棕色气体,C为无色气体,则B生成C的化学方程式:____________________________
(2)若常温时A为气态氢化物,B为淡黄色固体,C为气体,则CO2中混有少量气体C杂质可以用__________来除(写一种即可).
(3)若A为碱性氧化物,B为工业制玻璃的主要原料之一,常温时0.1mol/L的C溶液的pH值为13,则反应①的方程式为_______________________检验A、B、C中共有的金属离子的方法是 ____________。
(4)若常温时A为气体单质,①②③④均为化合反应,C的相对分子质量大于B,则C的电子式为:__________。
(5)若A是第三周期某金属的氧化物,B、C均为正盐且B的水溶液呈酸性,C的水溶液呈碱性。请写出反应③的离子方程式:______________________________________________________。
(6)若反应②③④均为化合反应,反应①为置换反应。当A为一种金属单质时,B中阳离子的检验方法为 ____________________________________________。(写出具体操作过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用粗ZnO(含FeO、CuO)制取金属锌的流程如下(部分步骤省略):
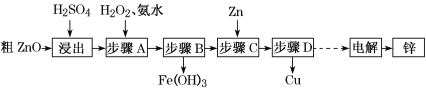
已知:几种离子形成氢氧化物沉淀时的pH如下表:
待沉淀的离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
开始沉淀时pH | 6.3 | 1.5 | 6.2 | 5.2 |
沉淀完全时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)酸浸粗氧化锌的过程中,为了加快酸浸速率,可采取的措施有______________ (写出一点即可)。
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2、Zn(OH)2,该步骤需控制溶液pH的范围是______________,该步骤中加入H2O2发生反应的离子方程式为_______________________________________。
(3)步骤D的操作名称为________________________________________________。
(4)由粗ZnO制取单质锌的另一种方法是将粗ZnO(含FeO、CuO)溶于NaOH溶液,ZnO全
部转化为Na2[Zn(OH)4]溶液,该反应的化学方程式为_________________________;然后将FeO、CuO过滤除去;再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阴极电极反应式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属镁和铁的说法中不正确的是 ( )
A.两者均能与盐酸反应
B.两者在常温下表面均易形成致密氧化膜,保护内层金属不被氧化
C.镁条点燃时发出耀眼的白光
D.一定条件下,铁与氧气、氯气、硫等非金属单质均能发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H)。下列推测肯定不正确的是
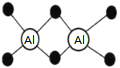
A. 该物质与水反应,属于氧化还原反应
B. Al2H6分子中氢为+1价,铝为﹣3价
C. Al2H6在空气中完全燃烧,产物为氧化铝和水
D. 氢铝化合物可能成为未来的储氢材料和火箭燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去其中较多量杂质的方法(括号内的物质是杂质)正确的是
A. 乙酸乙酯(乙酸):用氢氧化钠溶液洗涤,然后分液。
B. 苯(苯酚):用氢氧化钠溶液洗涤,然后过滤。
C. 硝基苯(苯):用水浴蒸馏。
D. 乙醇(水):加入生石灰搅拌后过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表和元素周期律的说法错误的是 ( )
A. Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B. 第二周期元素从Li到F,非金属性逐渐增强
C. 因为Mg比Na会多失去1个电子,所以Mg比Na的金属性强
D. O与S为同主族元素,且O比S的非金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com