
某盐X由非金属元素组成,不稳定加热时分解,生成等物质的量的气态氢化物A和B.A、C、E、G、I含有同种元素,C为黄色固体单质.B、D、F、H、J含有同种元素,B可与J反应生成盐.W是具有红色金属光泽的金属.上述物质转化关系如图,部分产物和条件已略去.请回答下列问题:

(1)X的化学式
(2)写出由E生成G的化学反应方程式
(3)写出反应B+Y→D+Z的化学方程式
(4)由E直接转换成I可以加入 (填写两种属于不同类别的物质).
(5)标况下,4.48LA与J的浓溶液反应转移1.6mole﹣,写出此反应的离子方程式 .
(6)将0.1mol/L 100mL I和0.4mol/L 100mL J溶液混合,加入1.92g W,加热,待充分反应后,所得溶液中W金属离子的物质的量浓度为 .
| 无机物的推断.. | |
| 分析: | C为黄色固体单质,应为S,盐X由非金属元素组成,应为铵盐,不稳定加热时分解,生成等物质的量的气态氢化物A和B,则为NH4HS,由转化关系可知A为H2S,B为NH3,Y为O2,则E为SO2,G为SO3,Z为H2O,I为H2SO4,W是具有红色金属光泽的金属,应为Cu,由Y+B的反应可知D为N2,F为NO,H为NO2,J为HNO3,结合对应物质的性质以及题目要求解答该题. |
| 解答: | 解:C为黄色固体单质,应为S,盐X由非金属元素组成,应为铵盐,不稳定加热时分解,生成等物质的量的气态氢化物A和B,则为NH4HS,由转化关系可知A为H2S,B为NH3,Y为O2,则E为SO2,G为SO3,Z为H2O,I为H2SO4,W是具有红色金属光泽的金属,应为Cu,由Y+B的反应可知D为N2,F为NO,H为NO2,J为HNO3, (1)由以上分析可知X为NH4HS,故答案为:NH4HS; (2)由E生成G的化学反应方程式为2SO2+O2 (3)反应B+Y→D+Z的化学反应为氨气的催化氧化,方程式为4NH3+3O2 (4)由二氧化硫直接氧化生成硫酸,可用氧化剂在水溶液中进行,常见氧化剂有Cl2(Br2、I2)、H2O2、HNO3、FeCl3、KMnO4, 故答案为:Cl2(Br2、I2)、H2O2、HNO3、FeCl3、KMnO4等氧化剂; (5)标况下,4.48LA,即0.2mol,与硝酸的浓溶液反应转移1.6mole﹣,则1molA转移8mol电子,应被氧化生成硫酸,反应的方程式为H2S+6H++8NO3﹣=SO42﹣+8NO2+4H2O, 故答案为:H2S+6H++8NO3﹣=SO42﹣+8NO2+4H2O; (6)将0.1mol/L 100mL H2SO4和0.4mol/L 100mL HNO3溶液混合,加入1.92g Cu,加热,待充分反应后, n(H+)=0.1mol/L×0.1L×2+0.4mol/L×0.1L=0.06mol, n(NO3﹣)=0.4mol/L×0.1L=0.04mol, n(Cu)= 发生3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O 3 8 2 3 0.03 0.06 0.04 可知H+不足,应完全反应,则生成n(Cu2+)= c(Cu2+)= 故答案为:0.1125 mol/L. |
| 点评: | 本题考查无机物的推断,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握物质的性质,题目突破口为物质的性质、颜色以及转化关系,答题时注意体会,难度中等. |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
化学 中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是( )
中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是( )
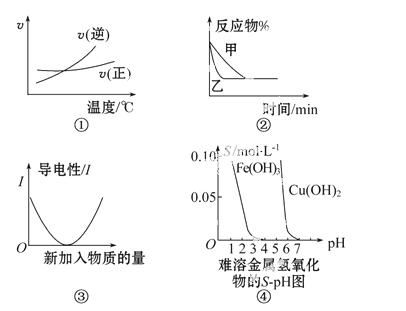
A.根据图①可判断可逆反应A2(g)+3B2(g)  2AB3(g),正反应是吸热反应
2AB3(g),正反应是吸热反应
B.图②表示压强对可逆反应2A(g)+2B(g)  3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④溶解度与溶液pH的关系,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO,至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
(1) 在标准状况下,测得1.32 g某气体的体积为0.672 L。则此气体的摩尔质量为 。
(2)等质量CO、CO2两种气体的的摩尔质量之比为 ;同温同压下的体积比为 ;其中氧元素的原子个数比为 。
(3)常用食醋除去水壶中的水垢,以氢氧化镁为例,表明反应原理(用离子方程式表示):
。
查看答案和解析>>
科目:高中化学 来源: 题型:
某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42﹣的物质的量浓度为6mol/L,则此溶液最多可溶解铁粉的质量为( )
|
| A. | 11.2 g | B. | 16.8 g | C. | 19.6 g | D. | 22.4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
Li﹣Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e﹣=Li2S+Fe.有关该电池的下列说法中,正确的是( )
|
| A. | Li﹣Al在电池中作为负极材料,该材料中Li的化合价为+1价 |
|
| B. | 该电池的电池反应式为:2Li+FeS=Li2S+Fe |
|
| C. | 负极的电极反应式为Al﹣3e﹣=Al3+ |
|
| D. | 充电时,阴极发生的电极反应式为:Li2S+Fe﹣2e﹣=2Li++FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 含1 mol溶质的任何溶液,物质的量浓度一定相等 |
|
| B. | 配制1 mol/L NaCl溶液1 L,其方法是:将58.5 g NaCl溶于1 L水中即可 |
|
| C. | 体积相同、物质的量浓度相同的同种溶液所含溶质的粒子数一定相同 |
|
| D. | 1 L 0.5 mol/L CaCl2溶液中,Ca2+与Cl﹣的物质的量浓度都是0.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,SO2作还原剂的是( )
|
| A. | 2H2S+SO2→3S↓+2H2O | B. | SO2+2Mg→2MgO+S |
|
| C. | Cl2+SO2+2H2O→H2SO4+2HCl | D. | SO2+2NaOH→Na2SO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中:( )
A.一定有SO42- B.SO42-、 SO32-或Ag+ 中至少有一种
C.一定无Ag+ D.可能有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色透明溶液中可能含有Na+、Ba2+、Cu2+、CO32-、Cl–、Mg2+中的一种或几种离子。
①向此溶液中滴加稀盐酸无明显现像。
②取少许①的溶液并加入少量的Na2SO4溶液,有白色沉淀产生。
③取②的上层清液并加入过量的NaOH溶液,无明显现象。
(1)原溶液中除了有Cl–外还一定含有的离子是 ,一定不含的离子是 ,不能确定是否含有的离子时 。
(2)②中反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com