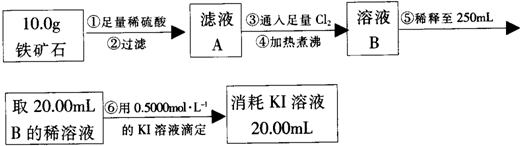
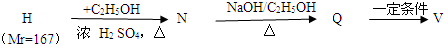分析:实验一:铁矿石和稀硫酸反应生成硫酸盐和水,然后过滤得到滤液A,向滤液中通入足量Cl
2,Cl
2具有强氧化性,能将Fe
2+氧化为Fe
3+,然后煮沸得到溶液B,将溶液B稀释,向溶液B中加入KI溶液,Fe
3+和碘离子发生氧化还原反应生成Fe
2+和I
2,先根据碘离子和铁离子关系式计算铁离子的物质的量,根据铁原子守恒计算其质量分数;
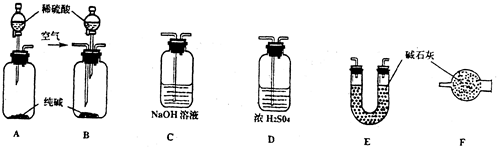
实验二:在加热条件下,氢气和铁矿石发生氧化还原反应生成Fe和水,碱石灰吸收生成的水蒸气,C中碱石灰吸收空气中水蒸气、二氧化碳,防止干扰测定结果;测得反应后装置B增重1.35g,B增重的质量为水的质量,
水中O元素质量=1.35g×
×100%=1.2g,由此计算氧元素质量分数.
解答:
解:实验一:铁矿石和稀硫酸反应生成硫酸盐和水,然后过滤得到滤液A,向滤液中通入足量Cl
2,Cl
2具有强氧化性,能将Fe
2+氧化为Fe
3+,然后煮沸得到溶液B,将溶液B稀释,向溶液B中加入KI溶液,Fe
3+和碘离子发生氧化还原反应生成Fe
2+和I
2;
(1)稀硫酸具有弱氧化性,不能将+2价铁氧化为+3价,所以滤液A中铁元素可能的存在形式Fe
2+、Fe
3+;Fe
2+具有还原性能被强氧化剂氧化、Fe
3+用KSCN溶液检验,向滤液A中加入KSCN溶液检验是否含有铁离子,如果溶液不变红色,说明不含铁离子,然后向溶液中加入氯水,如果此时溶液变红色,说明溶液中含有亚铁离子,故选ac;
故答案为:Fe
2+、Fe
3+;ac;
(2)升高温度抑制氯气溶解,所以步骤④中煮沸的目的是除去过量的氯气,防止对实验造成干扰,故答案为:除去过量氯气;
(3)步骤⑤中用到的玻璃仪器除了玻璃棒、胶头滴管,还有250mL容量瓶、烧杯,故答案为:250mL容量瓶、烧杯;
(4)a.滴定管用蒸馏水洗涤后必须用待装液润洗,故a正确;
b.锥形瓶不需要用待测液润洗,故b正确;
c.碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故c错误;
d.滴定过程中,三价铁可以和碘离子发生反应生成亚铁离子和碘单质,碘单质遇到淀粉溶液显示蓝色,故d正确;
e.滴定过程中,眼睛注视锥形瓶内溶液颜色变化,故e错误;
故选ce;
(5)碘离子和铁离子反应方程式为2 Fe
3++2 I
-=I
2+2Fe
2+,根据碘离子和铁离子的关系式得n( Fe
3+)=n( I
-)=0.5000mol/L×0.020L=0.01mol,250mLB溶液中n( Fe
3+)=0.01mol×12.5=0.125mol,
m(Fe)=0.125mol×56g/mol=7.0g,铁矿石中铁的质量分数为
×100%=70%,
故答案为:70%;
实验二:(6)在加热条件下,氢气和铁矿石发生氧化还原反应生成Fe和水,碱石灰吸收生成的水蒸气,C中碱石灰吸收空气中水蒸气、二氧化碳,防止干扰测定结果,
故答案为:防止空气中的水蒸气和CO
2进入B中,影响测定结果;
(7)测得反应后装置B增重1.35g,B增重的质量为水的质量,水中O元素质量=1.35g×
×100%=1.2g,铁矿石中氧元素质量分数=
×100%=24%,
故答案为:24%.





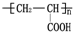 的单体,则A中所含官能团的名称是
的单体,则A中所含官能团的名称是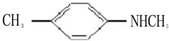 、
、