
| A. | 12 | B. | 17 | C. | 20 | D. | 30 |
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. |  与 与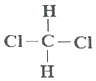 是同分异构体 是同分异构体 | |
| B. | 乙醇、乙酸、乙酸乙酯都能发生取代反应 | |
| C. | 相同质量的烃完全燃烧,耗氧量最小的是CH4 | |
| D. | 乙烯能使溴水和酸性KMnO4溶液褪色,且反应类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含有共价键 | |
| B. | 化学键是分子间强烈的作用力 | |
| C. | H、D、T表示三种氢元素 | |
| D. | 共价化合物中各原子都一定满足最外层8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的分子模型示意图: | |
| B. | 甲烷的电子式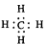 | |
| C. | 硫离子核外电子排布式1s22s22p63s23p4 | |
| D. | 中子数为8的碳原子86C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
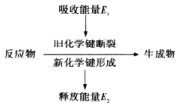
| A. | NaOH溶液与稀盐酸的反应 | B. | 锌与稀盐酸的反应 | ||
| C. | 氢氧化钡与氯化铵固体的反应 | D. | 一氧化碳在空气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充分利用太阳能,进行海水淡化 | |
| B. | 将秸秆露天焚烧,从而充分利用生物质能 | |
| C. | 以二氧化硅为光电池材料,将太阳能转化为电能 | |
| D. | 用甲烷与水作用生产清洁能源--H2,该过程的原子利用率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量 Cl2:Fe2+、H+、Al3+、Cl-、SO42- | |
| B. | 过量SO2:Fe2+、H+、Al3+、SO42- | |
| C. | 过量氨水:NH4+、AlO2-、SO42-、OH- | |
| D. | 过量 Na2O2:Na+、Fe3+、SO42-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com