
| A.生成物能量一定低于反应物总能量 |
| B.放热反应不必加热就一定能发生 |
| C.应用盖斯定律,可计算某些难以直接测量的反应的焓变 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的ΔH不同 |
科目:高中化学 来源:不详 题型:单选题
| A.有10NA个电子转移时,该反应放出1300kJ的能量 |
| B.有NA个水分子生成且为液体时,吸收1300kJ的能量 |
| C.有2NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稀醋酸与0.1 mol·L-1 NaOH溶液反应:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1 |
| B.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量,则Fe(s)+S(s)==="FeS(s)" ΔH=-95.6 kJ·mol-1 |
| C.氢气的燃烧热为285.5 kJ·mol-1,则水电解的热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1 |
| D.已知2C(s)+O2(g)==="2CO(g)" ΔH=-221 kJ·mol-1,则可知C的燃烧热为110.5 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
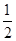 O2(g)=H2O(l) ΔH=-286 kJ/mol,判断H2O分子中O—H键的键能为( )
O2(g)=H2O(l) ΔH=-286 kJ/mol,判断H2O分子中O—H键的键能为( )| A.485.5 kJ/mol | B.610 kJ/mol |
| C.917 kJ/mol | D.1 220 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3+O2
2NH3+O2| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |

 2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.ΔH>0 |
| B.X能量一定高于M |
| C.该反应为放热反应 |
| D.该反应一定不必加热就可以发生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
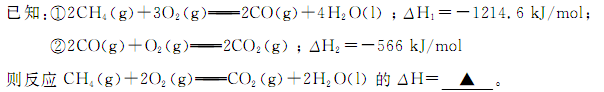
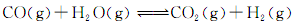 ,得到如下三组数据:
,得到如下三组数据: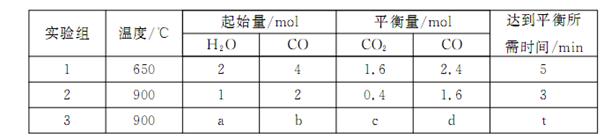

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 SO2(g) ΔH=a kJ·mol-1(a=-297.2)。分析下列说法,其中不正确的是( )
SO2(g) ΔH=a kJ·mol-1(a=-297.2)。分析下列说法,其中不正确的是( )| A.S(s)在O2(g)中燃烧的反应是放热反应 |
B.S(g)+O2(g) SO2(g) ΔH=b kJ·mol-1,则a>b SO2(g) ΔH=b kJ·mol-1,则a>b |
| C.1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和 |
| D.16 g固体硫在空气中充分燃烧,可吸收148.6 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 NH2CO2NH4(s) △H1="a" kJ·mol-1
NH2CO2NH4(s) △H1="a" kJ·mol-1 CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1 CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1

 (NH4)2CO3。下列物质中与尿素有类似性质的是______。
(NH4)2CO3。下列物质中与尿素有类似性质的是______。| A.NH2COONH4 | B.H2NOCCH2CH2CONH2 |
| C.HOCH2CH2OH | D.HOCH2CH2NH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com