
| A、洗净的锥形瓶和容量瓶可以放进烘箱中烘干 |
| B、用激光笔检验KI溶液中是否溶有淀粉 |
| C、配制硫酸亚铁溶液时,应将绿矾晶体溶于蒸馏水再加入一定量的铁粉 |
| D、用分液漏斗分离乙酸乙酯和饱和碳酸钠溶液时,应打开活塞,使乙酸乙酯缓慢流出 |


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
| A、把100 mL 3 mol/L的H2SO4跟100 mL 水混合,硫酸的物质的量浓度变为1.5 mol/L |
| B、把200 mL 3 mol/L的BaCl2溶液跟100 mL 3 mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol/L |
| C、把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% |
| D、把100 mL 1 mol/L的NaOH溶液取出10 mL后,NaOH溶液的浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
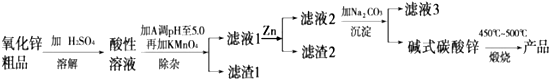
查看答案和解析>>
科目:高中化学 来源: 题型:
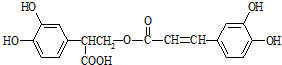 ,以邻苯二酚为原料合成迷迭香酸的路线为:
,以邻苯二酚为原料合成迷迭香酸的路线为:
| A、有机物A分子中所有原子一定在同一平面上 |
| B、有机物C在浓硫酸催化下水解的一种产物是B |
| C、有机物B可以发生取代、加成、消去、氧化反应 |
| D、1 mol迷迭香酸分别与足量的NaOH溶液、浓溴水反应,最多可消耗NaOH、Br2均为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
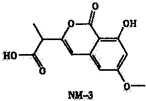 M-3是种正处于临床试验阶段的小分子抗癌药物,其结构如图所示(未表示出其空间构型).下列关于NM-3的性质描述正确的是( )
M-3是种正处于临床试验阶段的小分子抗癌药物,其结构如图所示(未表示出其空间构型).下列关于NM-3的性质描述正确的是( )| A、不含有手性碳原子 |
| B、能使溴的四氯化碳溶液褪色 |
| C、能与FeC13溶液发生显色反应 |
| D、1mo1该物质最多可与2mo1NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、Na+、SO42-、Cl- |
| B、K+、Na+、HCO3-、NO3- |
| C、OH-、HCO3-、Ca2+、Na+ |
| D、Ba2+、Na+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
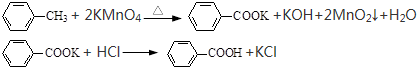

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com