
| A、450ml,52.65g |
| B、任意规格,52.65g |
| C、500 ml,58.5g |
| D、1000 ml,117g |
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
| A、② | B、①③⑥ | C、②④ | D、①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
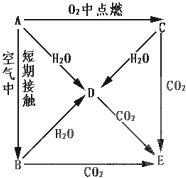 A、B、C、D、E五种物质都含有同一种活泼金属元素,它们按图所示关系相互转化,已知A为单质.
A、B、C、D、E五种物质都含有同一种活泼金属元素,它们按图所示关系相互转化,已知A为单质.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L1mol/LAlCl3溶液中 |
| B、2L1mol/LFeCl3溶液中 |
| C、1L2mol/LKCl溶液中 |
| D、2L3mol/LMgCl2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、T℃时,饱和CaCO3溶液与饱和CaF2溶液相比,后者Ca2+浓度大 |
| B、T℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合,会析出CaCO3固体 |
| C、T℃时,CaF2固体在20mL0.01 mol?L-1盐酸中的Ksp比在纯水中的Ksp大 |
| D、T℃时,在CaCO3悬浊液中加入NaF固体,CaCO3不可能转化为CaF2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com