
| A. | 原子半径:Z>Y>X | |
| B. | Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 | |
| C. | Na2Y2与水发生氧化还原反应时,Na2Y2只作氧化剂 | |
| D. | CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
分析 X、Y、Z是原子序数依次增大的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,则这三种元素核外电子数之和为18,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构,且X原子序数小于Z,则X是H、Z是F元素,根据这三种元素原子核外电子数知,Y是O元素;
A.电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.X和Z形成的化合物是HF,Z同主族元素和X形成的氢化物中只含分子间作用力,含有氢键的氢化物熔沸点较高;
C.过氧化钠和水反应时,过氧化钠是氧化剂和还原剂;
D.CaH2、CaO2和CaF2等3种化合物中,阳离子与阴离子个数比分别是1:2、1:1、1:2.
解答 解:X、Y、Z是原子序数依次增大的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,则这三种元素核外电子数之和为18,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构,且X原子序数小于Z,则X是H、Z是F元素,根据这三种元素原子核外电子数知,Y是O元素;
A.电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径Y>Z>X,故A错误;
B.X和Z形成的化合物是HF,Z同主族元素和X形成的氢化物中只含分子间作用力,含有氢键的氢化物熔沸点较高,HF中含有氢键、其它卤化氢只存在分子间作用力而不含氢键,所以HF熔沸点最高,故B正确;
C.过氧化钠和水反应时,过氧化钠是氧化剂和还原剂,水既不是氧化剂也不是还原剂,故C错误;
D.CaH2、CaO2和CaF2等3种化合物中,阳离子与阴离子个数比分别是1:2、1:1、1:2,故D错误;
故选B.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析判断能力,涉及元素判断、元素周期律、氢键、氧化还原反应、化学键等知识点,明确基本反应原理、元素周期律及基本概念是解本题关键,注意D中过氧化钙中阴离子为过氧根离子而不是氧离子,为易错点.


科目:高中化学 来源: 题型:解答题
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
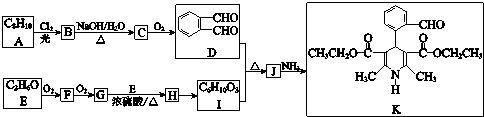
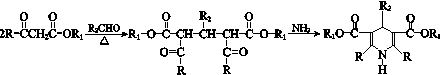
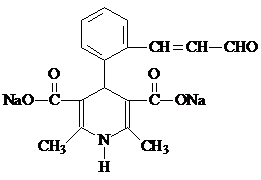
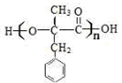
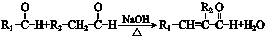 (R、R1、R2表示氢原子或烃基)
(R、R1、R2表示氢原子或烃基) .
.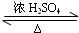 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.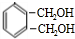 +O2 $→_{△}^{催化剂}$
+O2 $→_{△}^{催化剂}$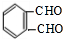 +2H2O.
+2H2O.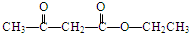 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常用的食品包装薄膜的主要成分是聚乙烯或聚氯乙烯塑料 | |
| B. | 食盐可作调味剂、食品防腐剂,还可用于调节体液电解质平衡 | |
| C. | 可利用米汤检验含碘盐的真假 | |
| D. | 利用厨房中的物品可以区别纯净的花生油与菜籽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| 实验步骤 | 实验现象 | 实验结论 |
| 向盛有5mL 15%的H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中. | 无明显现象 | ①Cl-不具有催化作用或猜想3不正确 |
| 向盛有5mL 15%的H2O2溶液的试管中加入少量的FeCl3固体,然后把带火星的木条伸入试管中. | ②试管中有大量气泡产生,带火星的木条复燃 | ③Fe3+具有催化作用或猜想2正确 |
| 实验编号 | 温度/℃ | Na2S2O3 | V(H2SO4)/mL | V(H2O)/mL | |
| c/mol•L-1 | V/mL | ||||
| ① | 25 | 0.1 | 5.0 | 10.0 | a |
| ② | 25 | 0.1 | 10.0 | 10.0 | 0 |
| ③ | 25 | 0.1 | 5.0 | 5.0 | b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20种 | B. | 16种 | C. | 10种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
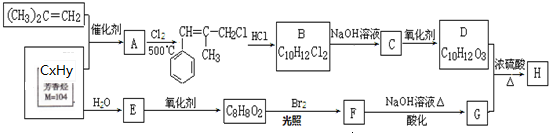
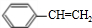
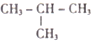 合成(CH3)2C=CH2的路线为:
合成(CH3)2C=CH2的路线为: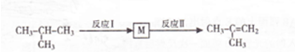 ,反应Ⅰ的条件为光照,写出反应Ⅱ的化学方程式
,反应Ⅰ的条件为光照,写出反应Ⅱ的化学方程式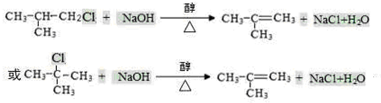
 +2NaOH $→_{△}^{水}$
+2NaOH $→_{△}^{水}$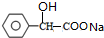 +NaBr+H2O
+NaBr+H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 19g H3O+ 共用的电子对数为8NA | |
| B. | 将含有NO2与N2O4分子共约NA个的混合气,温度降至标准状况,气体体积约为22.4L | |
| C. | 含10.6g Na2CO3溶液中的离子总数为0.3NA | |
| D. | 0℃、101KPa下,22.4L氦气含质子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com