
按要求回答下列问题:
(1)已知:4Al(s)+3O2(g)===2Al2O3(s)
ΔH=-2 834.9 kJ·mol-1①
Fe2O3(s)+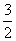 C(s)===
C(s)===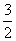 CO2(g)+2Fe(s)
CO2(g)+2Fe(s)
ΔH=+234.1 kJ·mol-1②
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1③
写出铝与氧化铁发生铝热反应的热化学方程式________________________________________________________________________。
(2)已知:
N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ·mol-1①
N2(g)+3H2(g)===2NH3(g)
ΔH=-92.4 kJ·mol-1②
2H2(g)+O2(g)===2H2O(g)
ΔH=-483.6 kJ·mol-1③
若有17 g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为________。
科目:高中化学 来源: 题型:
典型元素及化合物的特征性质
(1)Na、Al、Fe、Cu四种元素的单质中:
①能与水剧烈反应的是____________,反应的离子方程式:
________________________________________________________________________;
②能与NaOH溶液反应的是________,反应的离子方程式:
________________________________________________________________________,
其中作氧化剂的是______________________________________________________________;
③Cu在潮湿的空气中被腐蚀的化学方程式:
________________________________________________________________________;
④与氧气反应条件不同,反应产物不同的是
________________________________________________________________________。
(2)上述四种金属的氧化物中:
①能用作供氧剂的是________,写出一个化学方程式:
________________________________________________________________________;
②既能溶于酸溶液又能溶于强碱溶液的是______________________________________,
离子方程式分别为__________________,______________________________________;
③常温下为黑色固体的是____________________________________________________。
(3)上述四种金属的氢氧化物中:
①易在空气中被氧化的是__________,现象_____________________________________,
反应的化学方程式为_________________________________________________________;
②具有两性的是___________________________________________________________。
(4)上述四种金属形成的阳离子共有________种,其中既能表现还原性,又能表现氧化性的是________,检验Fe2+的方法是__________________________________;其中氧化性最强的是________,它腐蚀金属铜的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
正误判断,正确的打“√”,错误的打“×”
(1)所有的燃烧反应都是放热反应,所以不需要加热就能进行( )
(2)反应物的总能量低于生成物的总能量时,一定不能发生反应( )
(3)物理变化过程中,也可能有热量的变化( )
(4)C(石墨,s)===C(金刚石,s) ΔH>0,说明石墨比金刚石稳定( )
(5)一个反应的焓变因反应物的用量和反应条件的改变而发生改变( )
(6)催化剂能改变反应的焓变( )
(7)已知S(l)+O2(g)===SO2(g) ΔH=-293.23 kJ·mol-1,则S(s)+O2(g)===SO2(g)反应放出的热量大于293.23 kJ·mol-1( )
(8)同温同压下,H2(g)+Cl2(g)===2HCl(g),在光照和点燃条件下的ΔH不同( )
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2(g)2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则任何酸碱中和反应的热效应均为57.3 kJ
D.已知2C(s)+2O2(g)===2CO2(g) ΔH1,2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质间的反应肯定无明显实验现象的是 ( )
A.加热经SO2漂白的品红试液
B.将少量SO2通入NaOH溶液中
C.将新制的氯水在阳光下照射
D.将打磨的铝片加入浓NaOH溶液中一段时间
查看答案和解析>>
科目:高中化学 来源: 题型:
在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束后,所剩余的固体滤出后能被磁铁吸引,反应后溶液存在较多的阳离子是 ( )
A.Cu2+ B.Fe3+ C.Fe2+ D.H+
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应的反应过程中能量的变化如图所示,图中E1表示正反应的活化能,E2表示逆反应的活化能,下列有关叙述正确的是
A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.E1也可表示反应物断键需要吸收的总能量 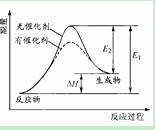
D.△H=E2-E1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是( )
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH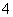 +HCO
+HCO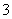 ===BaCO3↓+NH3·H2O+H2O
===BaCO3↓+NH3·H2O+H2O
B.实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O===4Fe3++4OH-
C.向碳酸氢铵溶液中加过量石灰水并加热:NH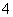 +OH-
+OH-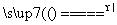 NH3↑+H2O
NH3↑+H2O
D.用酸化的高锰酸钾溶液氧化双氧水:2MnO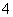 +6H++H2O2===2Mn2++3O2↑+4H2O
+6H++H2O2===2Mn2++3O2↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com