
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________,直到因加入一滴盐酸后,溶液由________色变为________色,并________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测NaOH 溶液的体积/mL | 0.100 0 mol·L-1 盐酸的体积/mL | ||
滴定前读数 | 滴定后读数 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据计算该NaOH溶液的物质的量浓度___________。
【答案】锥形瓶中溶液颜色变化 黄 橙 在半分钟内不变色 D 0.104 4 mol·L-1
【解析】
(1)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;滴定终点时溶液颜色由黄色突变为橙色,且半分钟内不变色;(2)根据c(待测)=![]() 分析不当操作对V(标准)的影响,以此判断浓度的误差;(3)先分析数据的有效性,然后求出平均消耗的V(盐酸),接着根据盐酸和NaOH反应求出c(NaOH)。
分析不当操作对V(标准)的影响,以此判断浓度的误差;(3)先分析数据的有效性,然后求出平均消耗的V(盐酸),接着根据盐酸和NaOH反应求出c(NaOH)。
(1)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂时,滴定终点时溶液颜色由黄色突变为橙色,且半分钟内不变色,故答案为:锥形瓶中溶液颜色变化;黄;橙;半分钟内不变色;
(2)A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸,标准液被稀释,造成V(标准)偏大,根据c(待测)=![]() 分析,测定c(待测)偏大,故A错误;B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=
分析,测定c(待测)偏大,故A错误;B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=![]() 分析,测定c(待测)无影响,故B错误;C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
分析,测定c(待测)无影响,故B错误;C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=![]() 分析,测定c(待测)偏大,故C错误;D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=
分析,测定c(待测)偏大,故C错误;D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=![]() 分析,测定c(待测)偏小,故D正确;故选D;
分析,测定c(待测)偏小,故D正确;故选D;
(3)第二次实验误差较大,舍去第2组数据,然后求出1、3组平均消耗V(盐酸)=26.10mL,
HCl + NaOH=NaCl+H2O
1 1
0.0261L×0.100 0 molL-1 0.025L×c(NaOH)
则:0.0261L×0.100 0 molL-1=0.025L×c(NaOH),解得:c(NaOH)=0.1044mol/L,故答案为:0.1044mol/L。


科目:高中化学 来源: 题型:
【题目】某化学课外小组为测定空气中CO2的含量,进行了如下实验:
①配制0.1000 mol/L 和0.01000 mol/L的标准盐酸。
②将2~3滴酚酞加入未知浓度的Ba(OH)2溶液10.00 mL中,并用0.1000 mol/L的标准盐酸进行滴定,结果用去盐酸19.60 mL。
③用测定的Ba(OH)2溶液吸收定量空气中的CO2。取Ba(OH)2溶液10.00 mL,放入100 mL容量瓶里加水至刻度线,取出稀释后的溶液放入密闭容器内,并通入10 L标准状况下的空气,振荡,这时生成沉淀。
④过滤上述所得浊液。
⑤取滤液20.00 mL,用0.01000 mol/L的盐酸滴定,用去盐酸34.80 mL。
请回答下列问题:
(1)配制标准盐酸时,需用下列哪些仪器?_____________________。
A.托盘天平 B.容量瓶 C.酸式滴定管 D.量筒 E.烧杯 F.胶头滴管 G.玻璃棒
(2)②操作中到达滴定终点时的现象是___________________________________________。
(3)Ba(OH)2溶液的物质的量浓度是________。
(4)此空气样品中含CO2的体积分数为________。
(5)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即注入第二种标准盐酸,并进行第二次滴定,使测定结果________(填“偏大”“偏小”或“无影响”)。
(6)在第一次滴定的时候未润洗滴定管,会使测定结果_______(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+3B(g)![]() 4C(g)+D(g), 已知起始浓度c(A)=4 mol·L-1,c(B)=3 mol·L-1,C、D浓度均等于0,反应开始2 秒后达到平衡状态,此时D 的平衡浓度为0.5 mol·L-1,则下列说法不正确的是( )
4C(g)+D(g), 已知起始浓度c(A)=4 mol·L-1,c(B)=3 mol·L-1,C、D浓度均等于0,反应开始2 秒后达到平衡状态,此时D 的平衡浓度为0.5 mol·L-1,则下列说法不正确的是( )
A. 反应速率v(C)= 1mol/(L·s) B. C的平衡浓度为4mol /L
C. A的转化率为25% D. B的平衡浓度为1.5mol /L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示。Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是
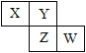
A. 原子半径:Z > Y > XB. 氢化物稳定性:X > Y
C. 氢化物沸点:Z > YD. 最高价氧化物对应的水化物酸性:W > Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为10 L的密闭容器中,进行如下反应:A(g)+2B(g)![]() C(g)+D(g),最初加入1.0 mol A和2.2 mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),最初加入1.0 mol A和2.2 mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
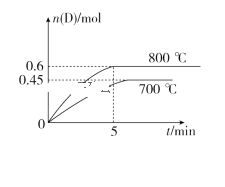
(1)800 ℃时,0~5 min内,以B表示的平均反应速率为________。
(2)能判断该反应达到化学平衡状态的依据是________(填字母)。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)利用图中数据计算800 ℃时的平衡常数K=________,该反应为________反应(填“吸热”或“放热”)。
(4)700 ℃时,某时刻测得另一同体积密闭容器中各物质的量如下:n(A)=1.1 mol,n(B)=2.6 mol,n(C)=0.9 mol,n(D)=0.9 mol,则此时该反应________(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池已用于航天飞机,其工作原理如图所示。关于该燃料电池的说法不正确的是
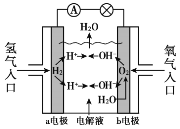
A. H2在负极发生氧化反应
B. 电子从a电极经外电路流向b电极
C. 供电时的总反应为:2H2 + O2 == 2H2O
D. 燃料电池的能量转化率可达100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全国平板玻璃生产企业大气污染物年排放总量逐年增加,对氮氧化物(NOx)排放的控制与监测已刻不容缓。回答下列问题:
(1)平板玻璃熔窑烟气中的NOx以温度型氮氧化物为主。其中NO在空气中容易被一种三原子气体单质氧化剂和光化学作用氧化成NO2,该氧化剂的分子式为_________。
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,2NO2(g)+N2(g)
4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,2NO2(g)+N2(g)![]() 4NO(g) ΔH=+293 kJ·mol-1,则反应CH4(g)+4NO(g)
4NO(g) ΔH=+293 kJ·mol-1,则反应CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)的ΔH=_________kJ·mol-1。
2N2(g)+CO2(g)+2H2O(g)的ΔH=_________kJ·mol-1。
(3)800℃时,在刚性反应器中以投料比为1:1的NO(g)与O2(g)反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。
t/min | 0 | 40 | 80 | 160 | 260 | 700 | ∞ |
p/kPa | 33.2 | 28.6 | 27.1 | 26.3 | 25.9 | 25.2 | 22.3 |
①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=52 min时,测得体系中p(O2)=11.4 kPa,则此时的p(NO)=_________kPa,v=_________kPa·min-1(计算结果保留1位小数)。
②若升高反应温度至900℃,则NO(g)与O2(g)完全反应后体系压强p∞(900℃)_________(填“大于”“等于”或“小于”)22.3kPa,原因是___________________________________。
③800℃时,反应N2O4(g)![]() 2NO2(g)的平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
2NO2(g)的平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
(4)对于反应2NO(g)+O2(g)![]() 2NO2(g),科研工作者提出如下反应历程:
2NO2(g),科研工作者提出如下反应历程:
第一步:2NO(g)![]() N2O2(g) 快速平衡
N2O2(g) 快速平衡
第二步:N2O2+O2(g)![]() 2NO2(g) 慢反应
2NO2(g) 慢反应
下列表述正确的是_________(填标号)。
A.v(第一步的逆反应)>v(第二步反应) B.反应的中间产物为N2O2
C.第二步中N2O2与O2的碰撞全部有效 D.第二步反应活化能较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com