
【题目】汽车排放的尾气是大气污染气体之一。如何减少污染气体的排放是科学家研究的热门课题。请回答下列问题:
使汽车排放的CO和NO在一定条件下发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),可有效地减少空气污染。若在一定温度下,将6 mol NO、8 mol CO充入10 L固定容积的容器中发生上述反应,反应过程中各物质的浓度变化如图1所示。
N2(g)+2CO2(g),可有效地减少空气污染。若在一定温度下,将6 mol NO、8 mol CO充入10 L固定容积的容器中发生上述反应,反应过程中各物质的浓度变化如图1所示。

(1)该反应的化学平衡常数K=____。NO的平衡转化率=______。
(2)15 min时,若改变反应条件,导致CO浓度发生如图1所示的变化,则改变的条件可能是____(填标号)。
a.缩小容器体积 b.增加CO2的量 c.体积不变通入少量氩气 d.加入催化剂
(3)当NO与CO的起始浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图2所示,则下列说法正确的是____(填标号)。
A.该反应ΔH<0 B.p1<p2<p3
C.升高温度正反应速率减小,逆反应速率增大
D.温度不变,增大压强,平衡常数增大
(4)以下说法中能判断反应2NO(g)+2CO(g)![]() N2 (g)+2CO2 (g)达到平衡的是____(填标号)。
N2 (g)+2CO2 (g)达到平衡的是____(填标号)。
A.反应物和生成物的物质的量相等
B.单位时间内生成1 mol NO同时生成1 mol CO2
C.混合气体压强不再发生变化
D.NO的浓度不再变化
(5)向反应容器中再分别充入下列气体,能使NO转化率增大的是____(填标号)。
A.O2 B.N2 C.CO D.NO
【答案】5 66.7% b A BCD C
【解析】
(1) 由图1可知,NO的浓度开始为0.8mol/L,达到平衡时为0.4mol/L,由三行式得:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始浓度(mol/L) 0.6 0.8 0 0
转化浓度(mol/L) 0.4 0.4 0.2 0.4
平衡浓度(mol/L) 0.2 0.4 0.2 0.4
则平衡常数K=![]() =
=![]() =5,
=5,
NO的平衡转化率=![]() 100%=
100%=![]() 100%=66.7%
100%=66.7%
故答案为:5;66.7%;
(2)平衡时一氧化碳的浓度增大,平衡向逆反应方向移动,
a.缩小容器体积平衡向正反应方向移动,故a错误;
b.增加CO2的量,平衡向逆反应方向移动,故b正确;
c.体积不变通入少量氩气,浓度不变,平衡不移动,故c错误;
d.加入催化剂不改变平衡移动,故d错误;
故答案为:b;
(3) A压强一定时,温度升高,CO的转化率降低,说明升高温度,平衡逆向移动,则该反应是放热反应,△H <0,故A正确;
B压强增大,平衡正向移动,则CO的转化率增大,所以P1>P2>P3,故B错误;
C.升高温度正逆反应速率均增大,故C错误;
D.平衡常数只跟温度有关,温度不变平衡常数不变,故D错误。
故答案为:A。
(4) A、平衡时各物质的物质的量多少取决于物质的起始物质的量和转化率,故反应物和生成物的物质的量不一定相等,故A错误;
B、单位时间内生成1 mol NO反映的是逆反应速率,同时生成1 mol CO2反映的是正反应速率,用不同物质表示的正、逆速率之比等于化学计量数之比,说明反应到达平衡,故B正确;
C、该反应前后气体分子数发生改变,未达到平衡状态时,混合气体的压强是发生改变的,若混合气体压强不再发生变化,说明反应到达平衡,故C正确;
D、NO的浓度不再变化,则各物质的浓度都不再变化,说明反应到达平衡,故D正确。
故答案为:BCD。
(5) A. 充入O2,O2和NO反应生成NO2,平衡向逆反应方向进行,NO的转化率降低,A错误;
B. 充入N2,增大生成物浓度,平衡向逆反应方向进行,NO的转化率降低,B错误;
C. 充入CO,增大反应物浓度,平衡向正反应方向进行,能使NO的转化率增大,C正确;D. 充入NO增大反应物浓度,平衡向正反应方向进行,但NO转化率降低,D错误。
故答案为:C。


科目:高中化学 来源: 题型:
【题目】下列电离方程式书写错误的是
A. MgCl2=Mg2++2Cl B. NaOH=Na++O2+H+
C. HCl=H+ +Cl D. K2SO4=2K++SO42
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常见的混合物分离或提纯的基本装置如下:
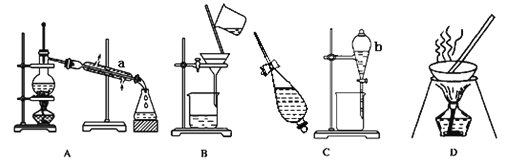
(1)写出仪器名称:a___________,b__________。
(2)从海带提取碘的操作如下,除特殊说明外,请在空白处填上装置中的序号:将干海带进行灼烧,海带灰中含有较多KI,将海带灰溶于水,然后__________得到澄清滤液;向滤液中加入硫酸和H2O2混合溶液,得到棕褐色含有单质碘的水溶液。该反应的离子方程式为:__________________。向碘的水溶液中加入适量CCl4,进行___________操作将上下两层溶液分开。将含有碘的CCl4溶液置于蒸馏烧瓶内进行___________操作,可以粗略从CCl4溶液中分离出碘。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中发生反应后各物质的物质的量随时间变化的曲线如图所示。

回答下列问题:
(1)该反应的反应物和生成物分别是_______________,反应方程式为_______。
(2)0~10 s的平均反应速率v(H2)= ________v(HI)=____________________。
(3)根据上述反应速率数值,分析用不同物质表示同一化学反应在同一时间内,化学反应速率值是否必须相同?_________________________________________。
(4)能否用I2(s)表达该反应的反应速率,为什么?__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下每一步都能实现的是
A. Si![]() SiO2
SiO2![]() H2SiO3
H2SiO3
B. Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
C. Al2O3![]() A1Cl3(aq)
A1Cl3(aq) ![]() 无水AlCl3
无水AlCl3
D. CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH3
CH3COOCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化一定是吸热反应的是:
A.凡需加热后才能发生的反应
B.所有的分解反应
C.将化学能转变为热能的反应
D.生成物总能量大于反应物总能量的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完全燃烧一定质量的无水乙醇,放出的热量为Q,已知为了完全吸收生成的二氧化碳,消耗50mL 8mol/L的氢氧化钠溶液,则无水乙醇的燃烧放出的热量不可能是( )
A. 10Q B. 5Q~10Q C. 大于10Q或小于5Q D. 小于8Q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com