
【题目】前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。回答下列问题:
(1)D2+的价层电子排布图为_____。
(2)四种元素中第一电离最小的是____,电负性最大的是____。(填元素符号)
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
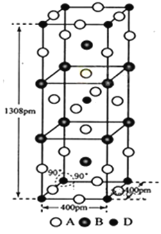
①该化合物的化学式为_____________;D的配位数为_______;
②列式计算该晶体的密度为___________g·cm-3。(列式并计算)
【答案】![]() K F K2NiF4 6
K F K2NiF4 6 ![]() =3.4
=3.4
【解析】
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,说明B、C、D为第四周期,则B为K,再根据前面信息得出A为F,C和D原子序数相差为2,则C为Fe,D为Ni。
(1)D为Ni,Ni为28号元素,价电子排布式为3d84s2,因此D2+的价层电子排布图为![]() ;故答案为:
;故答案为:![]() 。
。
(2)根据电离能同周期从左到右增大趋势,同主族从上到下逐渐减小,因此四种元素中第一电离最小的是K,电负性同周期从左到右逐渐增大,同主族从上到下逐渐减小,因此电负性最大的是F;故答案为:K;F。
(3)①根据晶胞计算A(F-)的个数![]() ,B(K+)的个数
,B(K+)的个数![]() ,D(Ni2+)的个数
,D(Ni2+)的个数![]() ,因此该化合物的化学式为K2NiF4;以顶点的D分析,其配位数是上下左右前后,共6;故答案为:K2NiF4;6。
,因此该化合物的化学式为K2NiF4;以顶点的D分析,其配位数是上下左右前后,共6;故答案为:K2NiF4;6。
②列式计算该晶体的密度为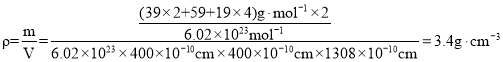 ;故答案为:
;故答案为: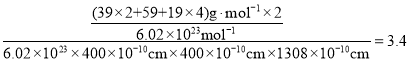 。
。


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】一定温度和压强下,将等质量的CH4、CO2、O2、SO2四种气体分别吹入四个不同的气球,下列说法中正确的是( )

A.气球②中装的是O2
B.气球①和气球③中气体分子数相等
C.气球①和气球④中气体物质的量之比为4∶1
D.气球③和气球④中气体密度之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20mL0.1molL﹣1NaOH溶液中逐滴加入0.2molL﹣1的某一元弱酸HX溶液,曲线如图所示,有关粒子浓度关系的比较中,错误的是( )
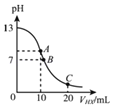
A.在A点:c(Na+)>c(OH﹣)>c(X﹣)>c(H+)
B.在B点:c(OH﹣)=c(H+)=c(Na+)=c(X﹣)
C.在C点:c(X﹣)>c(Na+)>c(H+)>c(OH﹣)
D.在C点:c(X﹣)+c(HX)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素在无机物和有机物中均充当了重要的角色,请回答下列问题:
(1)基态碳原子的价层电子排布图(轨道表达式)为__,其电子占据的能量最高的原子轨道的形状为__;C、N、O三种元素第一电离能最大的是__。
(2)有机物![]() 中碳原子的轨道杂化类型为__,分子中两种碳碳单键长的大小关系为①__②(填“>”、“<”或“=”)。
中碳原子的轨道杂化类型为__,分子中两种碳碳单键长的大小关系为①__②(填“>”、“<”或“=”)。
(3)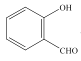 和
和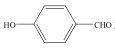 均可以形成氢键,则沸点较高的是__,原因是__。
均可以形成氢键,则沸点较高的是__,原因是__。
(4)石墨的结构及晶胞如图一所示,则石墨的密度为__g·cm-3(用含a、d、NA的表达式表示)。A的原子坐标为(![]() 、
、![]() 、0),则B的原子坐标为__。
、0),则B的原子坐标为__。
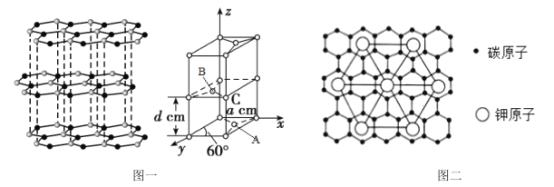
(5)石墨能与熔融的金属K作用,形成一种青铜色的化合物CxK,如图二所示,则x=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下:
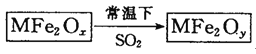
则下列判断正确的是( )
A.x>yB.MFe2Ox是还原剂C.SO2是该反应的催化剂D.SO2发生了置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的氧化物粉末可能含有FeO、Fe2O3中的一种或两种。某化学兴趣小组为验证该氧化物粉末的组成,做了如下实验:
(1)甲同学利用1mol/L的硫酸、KSCN溶液、酸性高锰酸钾溶液来确定其组成
编号 | 实验操作 | 实验现象与结论 |
① | 取少量粉末放入试管中,注入1mol/L的硫酸 | 粉末逐渐溶解,溶液呈黄绿色 |
② | 将①中所得溶液分成两份,向其中一份滴加几滴__________,振荡 | 若溶液________ ,说明有Fe2O3存在 |
③ | 向另一份溶液中加入少量__________,振荡 | 若溶液________ ,说明有FeO存在 |
(2)乙同学称取30.4g固体,按以下步骤进行实验:
步骤一 将固体置于烧杯中,加入1mol/L的硫酸将固体完全溶解
步骤二 往烧杯中先加入足量的氯水,充分反应后再加入足量的氢氧化钠溶液
步骤三 将步骤二所得的物质过滤洗涤后,灼烧至固体质量不再变化,得到32g红棕色固体
①步骤二中加入氯水的目的是__________________________________________;
②步骤三中沉淀洗涤的操作为__________________________________________;
③原固体中FeO和Fe2O3的物质的量之比为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种广谱、高效的杀菌消毒剂,有与氯气相似的强烈刺激性气味,易溶于水,沸点11℃,遇热不稳定易分解发生爆炸。一种工业制法用硫铁矿(主要成分为FeS2)还原氯酸钠制取二氧化氯,某研究小组在实验室设计如下装置制备ClO2的水溶液。

(1)三颈烧瓶中加入NaClO3溶液、浓H2SO4,通入空气,调节恒温器至60℃,通过固体加料器缓慢匀速加入硫铁矿粉末。反应开始时烧瓶内发生反应的离子方程式如下,请配平该方程式:__ClO3- +__FeS2+__H+=____ClO2+____Fe3++____SO42-+____H2O
(2)装置D的作用是__________。
(3)用上述反应完后的废液(除上述产物外,还有Al3+、Mg2+、H+、Cl-等)可制备摩尔盐,即(NH4)2Fe(SO4)2·6H2O。其操作流程如下:

回答下列问题:
①操作Ⅰ的名称为:___________。
②试剂X是___________,写出发生的主要反应的离子方程式__________。
③为测定(NH4)2Fe(SO4)2·6H2O晶体中铁的含量,某实验小组做了如下实验:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250mL溶液。取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.01000mol/L KMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4_被还原成Mn2+。测得消耗KMnO4溶液的平均体积为21.00mL。则该晶体中铁的质量分数为___________。(保留4位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据有关媒体报道,美国华裔科学家叶军领导一个研究小组成功制造出全球最准确的时钟,两亿年误差不足一秒。它是一个锶原子钟,比铯原子喷泉钟准确得多,估计将可大大促进不同的电讯网络的发展,将使全球各地的船只导航变得更为准确。请根据锶、铯在元素周期表中的位置,推断下列内容:
(1)锶元素属于________(填“金属”或“非金属”)元素,金属性比钙元素________(填“强”或“弱”),锶原子的核内质子数为________,原子核外有________个电子层,其原子结构示意图为________,其原子半径________镁(填“大于”、“小于”或“等于”);铯的原子核外共有________层电子,最外层电子数为________。
(2)铯与水起剧烈反应,放出________色气体,同时使滴有紫色石蕊试液的溶液显________色,因为______________________(写出化学方程式)。
(3)碳酸锶是________色粉末,与盐酸反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机合成的重要中间体F的一种合成路线如下:
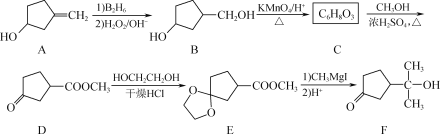
(1) F中含氧官能团的名称是________、________。
(2) C的结构简式为________。
(3) 从整个流程看,D→E的作用是___________。
(4) G为比E相对分子质量大14的同系物,H与G互为同分异构体且符合下列条件:
① 1 mol H能与2 mol NaHCO3反应;
② H能使溴的四氯化碳溶液褪色;
③ H分子中含有3种不同化学环境的氢。
则H的结构简式为________(写一种)。
(5) 写出以![]() 、CH3OH和CH3CH2MgI为主要原料制备
、CH3OH和CH3CH2MgI为主要原料制备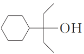 的合成路线____________ (无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线____________ (无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com