
某离子反应涉及H2O、ClO—、IO3—、OH—、I2、Cl—六种微粒。其中c(ClO—)随反应进行逐渐减小。下列判断错误的是
A.该反应的还原剂是I2
B.氧化剂与还原剂的物质的量之比为5:2
C.消耗l mol氧化剂,转移2 mol电子
D.反应后溶液的碱性明显减弱
B
【解析】
试题分析:由于在反应中c(ClO—)随反应进行逐渐减小,说明ClO—是反应物,Cl—应该是生成物,由于Cl元素的化合价降低,得到电子,所以ClO—是氧化剂,还应该有还原剂失去电子,根据题中的微粒及相应元素的化合价变化可知:I2是还原剂,IO3—是氧化产物,结合电荷守恒可知,OH-是反应物,H2O是生成物,反应的方程式是:5ClO—+ I2+ 2OH—= 5Cl—+ 2IO3—+H2O。A.在该反应中I2是还原剂,所以选项A正确;B.在反应中,氧化剂ClO—与还原剂I2的物质的量之比为5:1,错误;C.根据反应前后元素的化合价的变化可知:消耗l mol氧化剂,转移2 mol电子,正确;D.由于反应不断消耗OH-,反映还产生水,所以c(OH-)增加降低,因此反应后溶液的碱性明显减弱,正确。
考点:考查微粒在氧化还原反应中的作用、性质及电子转移的知识。


科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期第三次月考理综试卷(解析版) 题型:选择题
阿维A酯是一种皮肤病用药,可由原料X经过多步反应合成:
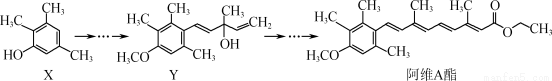
下列叙述正确的是
A.有机物X与Y互为同系物
B.有机物Y与阿维A酯均能与NaOH溶液反应
C.一定条件下1 mol阿维A酯能与4 mol H2发生加成反应
D.X中有6种化学环境不同的氢原子,Y中有1个手性碳原子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
下列说法合理的是
A.金属锂、镁在氧气中燃烧的产物分别为Li2O、MgO
B.H—F、H—O、H—N三个共价键的极性逐渐增强
C.若X+和Y2-的核外电子层结构相同,则元素电负性X>Y
D.邻羟基苯甲醛沸点高于对羟基苯甲醛是因为形成了分子内氢键
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.用醋酸溶液除水垢:CaCO3+2H+==Ca2++H2O+CO2↑
B.向FeBr2溶液中通入足量C12:Fe2++2Br一+C12==Fe3++Br2+2C1一
C.向Na[Al(OH)4]溶液中通入过量CO2:[Al(OH)4]一+CO2==Al(OH)3↓+HCO3一
D.向Ba(OH)2溶液滴加NaHSO4溶液至中性:H++SO42-+Ba2++OH一==BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高密市高三12月检测理综化学试卷(解析版) 题型:填空题
(12分)【化学——有机化学基础】
“心得安”是治疗心脏病的药物,下面是它的一种合成路线(具体反应条件和部分试剂略):
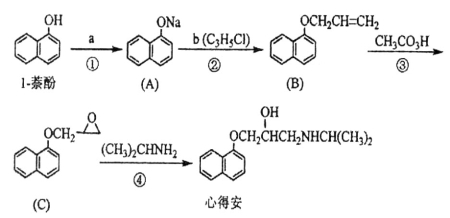
回答下列问题:
(1)试剂a是_________________。
(2)③的反应类型是______________。
(3)试剂b可由丙烷经三步反应合成:

反应l的试剂与条件__________________;
反应2的化学方程式为_______________________________________________;
反应3的反应方程式为_______________________________________________。
(4)芳香化合物D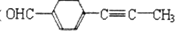 _____(填“是”或“不是”)1—萘酚的同分异构体。
_____(填“是”或“不是”)1—萘酚的同分异构体。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高密市高三12月检测理综化学试卷(解析版) 题型:选择题
下表中对应关系错误的是
A | NaCl=Na++Cl-;NH3?H2O | 均属于电离方程式 |
B | Ba2++SO42-=BaSO4↓; HCO3-+OH-=CO32-+H2O | 均可表示一类反应 |
C | SO2使酸性高锰酸钾溶液褪色; SO2使碱性酚酞溶液褪色 | 均属于SO2的同一性质 |
D | Cl2+2NaOH=NaCl+NaClO+H2O; 3S+ 6NaOH=2Na2S+Na2SO3+3H2O; | Cl2和S在反应中既作氧化剂又作还原剂 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高三上学期12月月考化学试卷(解析版) 题型:选择题
已知:(1)C(s)+O2(g)=CO2(g) △H1
(2)CO2(g)+C(s)=2CO(g) △H2
(3)2CO(g)+O2(g)=2CO2(g) △H3
(4)4Fe(s)+3O2(g)=2Fe2O3(s) △H4
(5)3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A、△H1=△H2+△H3 B、△H2>0,△H4>0
C、△H1>0,△H3<0 D、△H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省六校联盟高三第三次联考理科综合试卷(解析版) 题型:实验题
(16分)草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一) 探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:
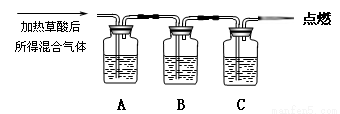
A、乙醇 B、 C、NaOH溶液。
(1)B中盛装的试剂 (填化学式)
(2)A中加入乙醇的目的是 。
(二) 探究草酸的酸性
将0.01mol草酸晶体(H2C2O4·2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是 (用离子方程式表示)。
(三) 用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理: MnO4- + H2C2O4 + = Mn2+ + CO2↑+ H2O
(1)配平上述离子方程式。
(2)滴定时KMnO4溶液应盛装于 (填 “酸式”或“碱式”)滴定管中。
Ⅱ、探究影响化学反应速率的因素
实验组别 | c(H2C2O4) /(mol/L) | V(H2C2O4) /ml | c(KMnO4) /(mol/L) | V(KMnO4) /ml | c(H2SO4) /(mol/L) | 褪色所需时间 | 实验 目的 |
1 | 0.2 | 2 | 0.0025 | 4 | 0.12 | 6'55'' | (a) |
0.2 | 2 | 0.005 | 4 | 0.12 | 5'17'' | ||
0.2 | 2 | 0.01 | 4 | 0.12 | 3'20'' | ||
0.2 | 2 | 0.02 | 4 | 0.12 | 9'05'' | ||
0.2 | 2 | 0.03 | 4 | 0.12 | 11'33'' | ||
0.2 | 2 | 0.04 | 4 | 0.12 | 14'20'' |
下表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
请回答:
(1)实验目的(a)是 ;
(2)根据表中数据在坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图像;
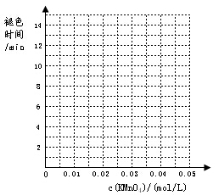
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省东莞市三校高二上学期期中联考化学试卷(解析版) 题型:选择题
在容积不变的密闭容器中存在如下反应: 2SO2(g)+O2(g)  2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
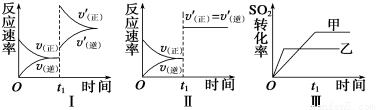
 A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
D.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com