
| A. | 在相同的条件下,2mol氢气与1 mol氧气的总能量小于2mol 水蒸气的总能量 | |
| B. | H2(g)+$\frac{1}{2}$ O2(g)→H2O(1)+Q1;Q1>241.8kJ | |
| C. | 氢气燃烧是放热反应,所以氢气和氧气反应不需要其他外界条件即可发生 | |
| D. | 任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量 |
分析 已知2H2(g)+O2(g)→2H2O(g)+483.6kJ,反应放热,反应物总能量大于生成物总能量,物质的聚集不同,能量不同,吸收或放出的热量不同,结合热化学方程式进行判断.
解答 解:A.反应放热,则在相同的条件下,2 mol氢气与1 mol氧气的总能量大于2 mol水蒸气的总能量,故A错误;
B.H2O(g)→H2O(l)放出热量,则H2(g)+$\frac{1}{2}$O2(g)=H2O(l)+Q1,则Q1>241.8kJ,故B正确;
C.氢气燃烧是放热反应,燃烧需要点燃,需要外界能量引发反应,故C错误;
D.反应热受外界条件的影响,外界条件不同,反应热不同,故D错误;
故选B.
点评 本题考查反应热与焓变,为高考高频考点,难度不大,注意把握热化学方程式的意义.


科目:高中化学 来源: 题型:选择题
| A. | HCl电离产生H+和Cl-,可判断HCl分子中存在离子键 | |
| B. | 阴、阳离子间通过静电引力所形成的化学键是离子键 | |
| C. | 化学变化过程,一定会破坏旧的化学键,同时形成新的化学键 | |
| D. | 不同元素组成的多原子分子中的化学键一定全是极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的沸点:Z一定高于Y | |
| B. | 最高价氧化物对应水化物的酸性:X强于Y | |
| C. | W、X、Y、Z都能分别与氯元素形成共价化合物 | |
| D. | 仅由W、Y、Z三种元素组成的化合物不可能属于盐类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化转化器中的铂催化剂可加快CO的氧化 | |
| B. | 铂表面做成蜂窝状更有利于提高催化效果 | |
| C. | 在铂催化下,NO、NO2可被CO还原成N2 | |
| D. | 碳氢化合物在铂催化下,被CO直接氧化成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m-n-2}{w•m}$ mol | B. | $\frac{w?m-n?}{n}$mol | C. | $\frac{w}{m}$(m-n-2)mol | D. | $\frac{w}{m}$(m-n+2)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
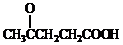 )合成聚芳酯E的路线(省略部分产物):
)合成聚芳酯E的路线(省略部分产物):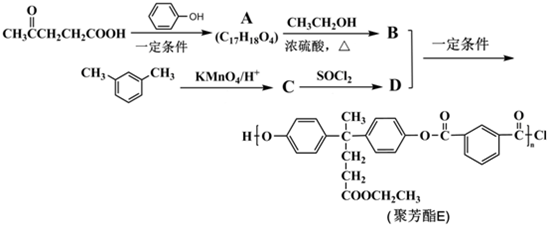
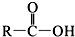 +SOCl2→
+SOCl2→ +SO2+HCl
+SO2+HCl +R′OH→
+R′OH→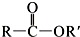 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)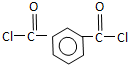 .
.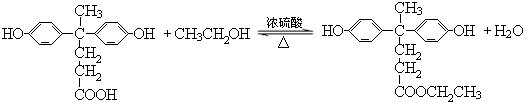 ,.
,.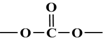 结构写出F与足量NaOH溶液共热反应的化学方程式:
结构写出F与足量NaOH溶液共热反应的化学方程式: .
.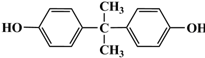 的路线.
的路线.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
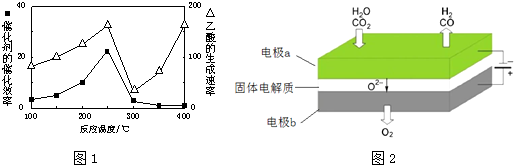
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
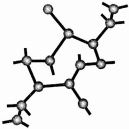 氮化硅是一种新型无机非金属材料,主要有α-氮化硅和β-氮化硅两种晶型,它们都是由[SiN4]正四面体共用顶角原子构成的三维空间网络结构,β-氮化硅的结构如图所示:
氮化硅是一种新型无机非金属材料,主要有α-氮化硅和β-氮化硅两种晶型,它们都是由[SiN4]正四面体共用顶角原子构成的三维空间网络结构,β-氮化硅的结构如图所示: ,若去掉氢原子后的剩余部分即Si44-(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体彼此用3个角氧相连后,形成离子的化学式为Si3O96-.n个硅氧四面体彼此用4个角氧连接后形成的物质的化学式是SiO2.
,若去掉氢原子后的剩余部分即Si44-(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体彼此用3个角氧相连后,形成离子的化学式为Si3O96-.n个硅氧四面体彼此用4个角氧连接后形成的物质的化学式是SiO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
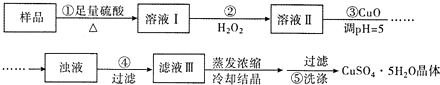
| A. | 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| B. | 步骤②可用氯水、硝酸等强氧化剂代替H2O2 | |
| C. | 步骤③用 CuCO3代替CuO也可调节溶液的pH | |
| D. | 步骤⑤的操作为:向漏斗中加人少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com