
| A、2,3-二甲基-4-乙基己烷的名称是正确的 |
| B、有机物CH3CO18OH和C2H5OH发生酯化反应的产物为CH3CO18OC2H5和H2O |
C、肌醇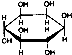 与葡萄糖 与葡萄糖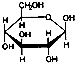 均含有六元环,互为同分异构体 均含有六元环,互为同分异构体 |
D、有机物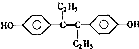 能发生加成反应,氧化反应和还原反应 能发生加成反应,氧化反应和还原反应 |
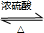 CH3COOCH2CH3+H218O,故B错误;
CH3COOCH2CH3+H218O,故B错误;

科目:高中化学 来源: 题型:
| A、在c(HCO3-)=0.1mol/L的溶液中:Na+、AlO2-、Cl-、NO3- |
| B、在既能溶解Al(OH)3又能溶解H2SiO3的溶液中:Na+、NH4+、K+、NO3- |
| C、在水电离出的c(H+)=1×10-14mol/L的溶液中:Na+、SO42-、ClO-、Cl- |
| D、在pH=13的溶液中:SO32-、S2-、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:C>N>O |
| B、熔点:SiO2>CO2>H2O |
| C、热稳定性:NaHCO3>Na2CO3>H2CO3 |
| D、氧化性:Na+>Mg2+>Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
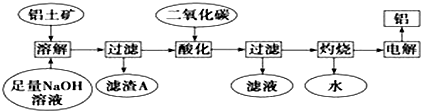
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出24.0g固体,配成500mL溶液,请计算
如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出24.0g固体,配成500mL溶液,请计算查看答案和解析>>
科目:高中化学 来源: 题型:
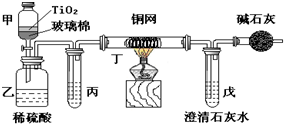 未来生活中金属钛的运用越来越广泛,如可在催化剂TiO2作用下,先用NaClO将CN-(毒性很强)氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用如图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题:
未来生活中金属钛的运用越来越广泛,如可在催化剂TiO2作用下,先用NaClO将CN-(毒性很强)氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用如图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com