
【题目】回收铅蓄电池的电极填充物(铅膏,主要含PbO、PbO2、PbSO4),可制备热稳定剂三盐基硫酸铅(组成可表示为3PbOPbSO4H2O),其实验流程如下: 
(1)物质X可以循环利用,该物质是 . 最后一次过滤之后需要洗涤,检验三盐基硫酸铅是否洗净的方法是 .
(2)从滤液A可提取出一种含结晶水的钠盐副产品.若检验该晶体中结晶水的含量,所需的硅酸盐材质仪器有、、、玻璃棒、石棉网、干燥器等.
(3)流程中不直接利用H2SO4溶液与PbO、PbCO3反应制取PbSO4 , 原因可能是 .
(4)生成三盐基硫酸铅的离子反应方程式为 .
(5)向铅膏浆液中加入Na2SO4溶液的目的是将其中的PbO2还原为PbO.若实验中所取铅膏的质量为47.8g,其中PbO2的质量分数为15.0%,则要将PbO2全部还原,至少需加mL 1.0molL﹣lNa2SO3溶液.
【答案】
(1)HNO3溶液;取少量溶液,加入足量稀盐酸,再加氯化钡溶液,观察是否产生白色沉淀
(2)坩埚;酒精灯;泥三角
(3)PbSO4不溶于水,覆盖在固体表面阻碍反应的进一步发生
(4)4PbSO4+6OH﹣=3PbO?PbSO4?H2O+3SO42﹣+2H2O
(5)30
【解析】解:(1)分析流程可知,PbO和PbCO3在硝酸的作用下转化成Pb(NO3).Pb(NO3)中加稀H2SO4转化成PbSO4和硝酸,因此X为HNO3 , 可循环利用,检验硫酸根离子的方法为:取少量晶体溶于蒸馏水,然后用盐酸酸化,再滴BaCl2溶液,若出现白色沉淀,即证明该晶体中含有SO42﹣ , 所以答案是:HNO3溶液;取少量溶液,加入足量稀盐酸,再加氯化钡溶液,观察是否产生白色沉淀;(2)测量晶体中结晶水的含量,实验步骤为:①研磨 ②称量空坩埚和装有试样的坩埚的质量 ③加热 ④冷却 ⑤称量 ⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1g为止 ⑦根据实验数据计算晶体中结晶水的含量,所以所需的硅酸盐材质仪器有玻璃棒、石棉网、干燥器、坩埚、酒精灯、泥三角,
所以答案是:坩埚;酒精灯;泥三角;(3)生成的硫酸铅难溶于水,覆盖在固体PbO、PbCO3的表面,阻碍反应的进一步发生,所以答案是:PbSO4不溶于水,覆盖在固体表面阻碍反应的进一步发生;(4)从流程看,硫酸铅和氢氧化钠反应生成三盐基硫酸铅和硫酸钠,反应方程式为:4PbSO4+6NaOH=3PbOPbSO4H2O+3Na2SO4+2H2O,离子方程式为:
4PbSO4+6OH﹣=3PbOPbSO4H2O+3SO42﹣+2H2O,所以答案是:4PbSO4+6OH﹣=3PbOPbSO4H2O+3SO42﹣+2H2O;(5)氧化铅的物质的量为: ![]() =0.03mol,
=0.03mol,
PbO2 ~ | Na2SO3 |
1mol | 1mol |
0.03mol | n |
n=0.03mol,V= ![]() =0.03L=30mL,
=0.03L=30mL,
所以答案是:30.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在酸性高锰酸钾溶液中加入Na2O2粉末,高锰酸钾溶液褪色,其中发生反应的离子方程式为:2MnO4﹣+16H++5Na2O2═2Mn2++5O2↑+8H2O+10Na+下列判断正确的是( )
A.高锰酸钾是氧化剂,Na2O2既是氧化剂,又是还原剂
B.反应的氧化产物Mn2+
C.当反应产生标准状况下2.24L O2 时,反应转移的电子为0.2mol
D.向高锰酸钾溶液滴加浓盐酸可以得到酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mL 0.018mol/LAgNO3溶液中加入50mL 0.02molL﹣1盐酸.已知AgCl(s)的溶度积常数Ksp=1×10﹣10 , 混合后溶液的体积变化忽略不计.下列说法不正确的是( )
A.混合后,溶液中肯定有沉淀生成
B.沉淀生成后溶液中Ag+的浓度为1×10﹣5 molL﹣1
C.沉淀生成后溶液的pH=2
D.混合后,升高温度,溶液中Ag+的浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积): 
下列说法正确的是( )
A.固体混合物中一定含有Al,但质量不可确定
B.固体混合物中可能含有MgCl2和AlCl3
C.固体混合物中一定含有MgCl2和FeCl2
D.固体混合物中一定含有(NH4)2SO4、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
A.加等量的水后硫酸中水电离出的c(H+)与硫酸铝中水电离出的c(H+)的比值比稀释前的比值增大
B.a点溶液中有:c(H+)+c(Al3+)=c(OH﹣)+c(SO42﹣)
C.体积和pH都相同的稀硫酸和硫酸铝溶液与等浓度的NaOH反应,消耗NaOH的体积相等
D.b、c两溶液水电离出的c(OH﹣)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制某物质的量浓度的溶液时,下列情况会造成所配溶液浓度偏小的是
A. 容量瓶中有蒸馏水B. 溶液转移至容量瓶时,未洗涤玻璃棒和烧杯
C. 溶液未冷至室温就定容D. 定容时俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3和HNO3是重要的工业产品,下图为合成氨以及氨氧化制硝酸的流程。
(1)N2约占空气体积的 , 从空气中分离出N2利用的原理是。
(2)合成塔中发生反应的化学方程式是,该反应中的氧化剂是。22.4LN2(标准状况)完全反应时,转移电子的物质的量是。
(3)氧化炉中发生反应的化学方程式是。
(4)吸收塔中通入空气的作用是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( ) 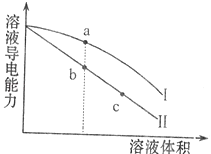
A.两溶液稀释前的浓度相同
B.a、b、c三点溶液的pH由大到小顺序为a>b>c
C.a点的Kw值比b点的Kw值大
D.a点水电离的c(H+)小于c点水电离的c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com