
【题目】下列解释事实的方程式正确的是( )
A. 用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3+2H+=SO2↑+S↓+2Na++H2O
B. 氢氧化亚铁暴露于空气中会变色:4Fe(OH)2+O2+2H2O=4Fe(OH)3
C. 向Ca(ClO)2溶液中通入过量CO2制取次氯酸: Ca2++ClO-+H2O+CO2=2HClO+CaCO3↓
D. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
【答案】B
【解析】
A.硫代硫酸钠是可溶性盐,可拆分,则用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠,正确的离子方程式为:S2O32-+2H+═SO2↑+S↓+H2O,故A错误;B.氢氧化亚铁暴露于空气中被氧化生成氢氧化铁,反应方程式为4Fe(OH)2 +O2 +2H2O═4 Fe(OH)3,故B正确;C.二氧化碳过量反应生成可溶性的碳酸氢钙,则向Ca(ClO)2溶液中通入过量CO2制取次氯酸,离子方程式:ClO-+H2O+CO2=HClO+HCO3-,故C错误;D.HClO是弱酸,则氯气用于自来水消毒发生反应的离子方程式为Cl2 + H2O ![]() H++ Cl-+ HClO,故D错误;故答案为B。
H++ Cl-+ HClO,故D错误;故答案为B。


科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )

选项 | ① | ② | ③ | 实验结论 |
A | 浓盐酸 | KMnO4 | 紫色石蕊试液 | 氯气具有酸性、漂白性 |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
C | 稀硝酸 | Na2SO3 | 品红溶液 | 实验室制取并检验SO2 |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:N>C>Si |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是人类文明发展的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)工业生产粗硅的反应有:
SiO2+2C![]() Si(粗)+2CO↑
Si(粗)+2CO↑
SiO2+3C![]() SiC+2CO↑
SiC+2CO↑
两个反应的氧化剂分别为____、___。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为___。
(2)工业上可以通过如下图所示的流程制取纯硅:
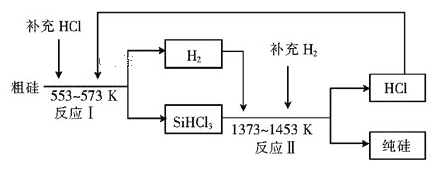
①若反应I为Si(粗)+3HCl![]() SiHCl3+H2,则反应II的化学方程式为____。
SiHCl3+H2,则反应II的化学方程式为____。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: P4(g)+6Cl2(g)=4PCl3(g) △H=a kJ/mol P4(g)+10Cl2(g)=4PCl5(g) △H=b kJ/mol P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ/mol,PCl3中P-Cl键的键能为1.2c kJ/mol。 下列叙述正确的是 ( )
A. P-P键的键能大于P-Cl键的键能
B. 可求Cl2(g)+ PCl3(g)=4PCl5(s)的反应热△H
C. Cl-Cl键的键能为![]() kJ/mol
kJ/mol
D. P-P键的键能为![]() kJ/mol
kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气(液氯)、84消毒液、漂白粉等都是含氯消毒剂。
(1)实验室中用MnO2或KMnO4与浓盐酸反应制取氯气。若用二者制备等质量的氯气消耗HCl的物质的量之比为__________。
(2)由于氯气不易保存,生活中常用的含氯消毒剂为漂白粉和84消毒液。
①用氯气制漂白粉的化学方程式为_______;该反应中氧化剂与还原剂的物质的量之比为________。
②含氯消毒剂的消毒能力可以用氧化性来衡量。商业上常用“有效氯”来说明消毒剂的消毒能力。“有效氯”的基本含义是指一定质量的这种消毒剂与多少质量的氯气的氧化能力相当,其数值可以用此时氯气的质量对消毒剂质量的百分比来表示。若100g某84消毒液产品中含有7.45g次氯酸钠,该产品的有效氯含量为__________(要求写出简要计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碳酸钠、碳酸氢钠的说法正确的是( )

A.25℃时,碳酸氢钠在水中的溶解度比碳酸钠大
B.可用澄清石灰水鉴别碳酸钠溶液和碳酸氢钠溶液
C.可用如图所示装置比较Na2CO3和 NaHCO3的热稳定性
D.常温下,浓度均为0.1mol·L-1时,碱性:NaHCO3> Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验方案或说法正确的是
A.  实验室制取乙酸乙酯
实验室制取乙酸乙酯
B.  比较NaHCO3和Na2CO3的热稳定性
比较NaHCO3和Na2CO3的热稳定性
C.  脱脂棉燃烧证明过氧化钠与水反应放热
脱脂棉燃烧证明过氧化钠与水反应放热
D.  a处有红色物质生成,b处变蓝,证明X一定是H2
a处有红色物质生成,b处变蓝,证明X一定是H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中的NO3对人类健康会产生危害,为了降低饮用水中NO3的浓度,可以在碱性条件下用铝粉将NO3还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(1)上述反应中,被氧化的元素_________,还原产物是________。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________。
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(3)反应中每生成标况下22.4L N2,转移_______mol电子。
(4)请配平下列离子方程式。
____Fe2++____H+ +____NO3=____Fe3+ +____N2O↑+____H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图装置制取(该反应放出热量)。制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象。
![]()

下列说法错误的是
A.制备溴苯的反应属于取代反应
B.白雾出现是因为HBr易挥发且极易溶于水
C.装置图中长直玻璃导管仅起导气作用
D.溴苯中溶有少量的溴,可用NaOH溶液洗涤除去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com