
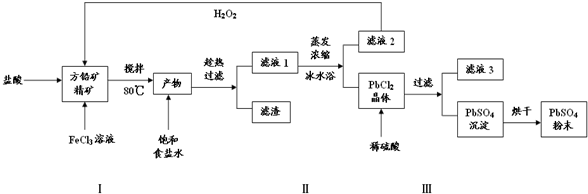
分析 本题是利用方铅矿精矿(PbS)直接制备硫酸铅粉末的工业流程,考查了用离子方程式描述反应原理,结合平衡的理论知识通过降温促进晶体的析出,添加稀酸抑制水解等,涉及铅蓄电池的充放电原理并能写出阴极电解反应式,据此可解答;
(1)步骤Ⅰ中生成物为PbCl2和S,则加入的盐酸、氯化铁与PbS发生氧化还原反应,S元素化合价升高,则铁元素的化合价降低,据此写出反应的离子方程式;滤液2的主要成分是FeCl2,与过氧化氢反应又生成FeCl3,据此写出反应的离子方程式;根据Fe3+、Pb2+以氢氧化物形式完全沉淀时溶液的pH进行判断;
(2)根据加入饱和食盐水后存在化学平衡:PbCl2(s)+2Cl-(aq)?PbCl4-(aq)△H>0,而在冰水浴中,温度较低,根据温度对化学平衡的影响判断使用冰水浴的原因;
(3)已知:Ksp(PbSO4)=1.08×10-8<Ksp(PbCl2)=1.6×10-5,PbCl2晶体转化为PbSO4沉淀是因为PbCl2中加入稀硫酸破坏了氯化铅的溶解平衡,使溶解平衡正向移动生成硫酸铅;
(4)根据(3)可知PbCl2转化为PbSO4同时生成HCl,则滤液3为盐酸;
(5)根据充电时铅蓄电池工作原理为电解,根据电解原理及化合价变化写出充电时阴极的电极反应式.
解答 解:(1)步骤Ⅰ中生成PbCl2和S,则加入的盐酸、氯化铁与PbS发生氧化还原反应,S元素化合价升高,则铁元素的化合价降低,反应的离子方程式为:PbS+2Fe3++2Cl-=PbCl2+2Fe2++S;滤液2的主要成分是FeCl2,与过氧化氢反应又生成FeCl3,双氧水作氧化剂,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04,所以加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是抑制Fe3+、Pb2+的水解,
故答案为:PbS+2Fe3++2Cl-=PbCl2+2Fe2++S;2Fe2++H2O2+2H+=2Fe3++2H2O;抑制Fe3+、Pb2+的水解;
(2)加入饱和食盐水后存在化学平衡:PbCl2(s)+2Cl-(aq)?PbCl42-(aq)△H>0,在冰水浴中,温度较低,使平衡向着逆向移动,从而生成PbCl2晶体而析出,故答案为:用冰水浴使反应PbCl2(s)+2Cl-(aq)$\stackrel{降温}{?}$PbCl42-(aq)逆向移动,使PbCl42-不断转化为PbCl2晶体而析出;
(3)根据题中信息可知:Ksp(PbSO4)=1.08×10-8<Ksp(PbCl2)=1.6×10-5,结合沉淀的转化,PbCl2晶体转化为PbSO4沉淀是因为PbCl2中加入稀硫酸破坏了氯化铅的溶解平衡,使溶解平衡正向移动生成硫酸铅,反应的离子方程式为:PbCl2(s)+SO42-(aq)?PbSO4(s)+2Cl-(aq),故答案为:PbCl2(s)+SO42-(aq)?PbSO4(s)+2Cl-(aq);
(4)由(3)可知PbCl2转化为PbSO4同时生成HCl,所以滤液3为盐酸溶液,故答案为:盐酸;
(5)铅蓄电池充电时是把电能转化为化学能,相当于电解池装置,所以阴极发生还原反应,Pb的化合价降低成为单质Pb,所以充电时阴极的电极反应式为:PbSO4+2e-=Pb+SO42-,故答案为:PbSO4+2e-=Pb+SO42-.
点评 本题通过硫酸铅粉末的制备,考查了物质制备实验方案的设计方法,题目难度中等,注意掌握常见物质制备实验方案的设计方法,正确分析、理解制备流程为解答关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 通过装有NaOH溶液的洗气瓶可除去二氧化碳中混有的HCl气体 | |
| B. | 向饱和的NaOH溶液中加入少量的Na2O固体后,恢复到原来的温度时,溶质的物质的量浓度增大 | |
| C. | 某无色溶液中加入BaCl2溶液,有白色沉淀生成,再滴入稀盐酸,沉淀不溶解,说明该溶液中一定含有SO42- | |
| D. | 回收KMnO4加热分解产生的MnO2,可用溶解→过滤→洗涤→干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2min时,M的物质的量浓度为0.6mol•L-1 | |
| B. | 4min时,用E表示的反应速率为0.2mol•L-1•min-1 | |
| C. | 4min后,向容器中充入不参与反应的稀有气体,M的物质的量不变 | |
| D. | 4min时,M的转化率为80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 55.5 | B. | 111 | C. | 111g/mol | D. | 55.5 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | W | |
| 初始浓度/mol.L-1 | 1.0 | 2.0 | 0 | 0 |
| 平衡浓度/mol.L-1 | 0.4 | 0.2 | 1.2 | 0.6 |
| A. | 反应达到平衡时,Y的转化率为90% | |
| B. | 反应可表示为X(g)+3Y(g)═2Z(g)+W(g)平衡常数为280 L•mol-1 | |
| C. | 增大压强平衡向正反应方向移动,平衡常数不变 | |
| D. | 改变温度,平衡常数会随之改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com