
| A. | 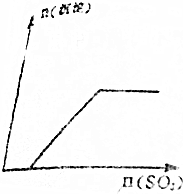 | B. | 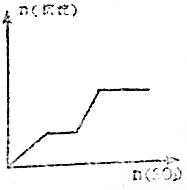 | ||
| C. | 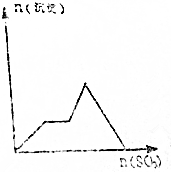 | D. |  |
分析 将足量的SO3不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,发生反应先后顺序为Ba(OH)2+SO3=BaSO4↓+H2O、2KOH+SO3=K2SO4+H2O、2KAlO2+SO3+3H2O=2Al(OH)3↓+K2SO4、2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O,据此分析解答.
解答 解:将足量的SO3不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,
①先发生反应:Ba(OH)2+SO3=BaSO4↓+H2O,生成沉淀硫酸钡与通入三氧化硫的物质的量之比为1:1,
②氢氧化钡反应后再发生反应:2KOH+SO3=K2SO4+H2O,则此段沉淀的物质的量不变;
③KOH反应完全后,KAlO2与三氧化硫反应生成氢氧化铝沉淀:2KAlO2+SO3+3H2O=2Al(OH)3↓+K2SO4,生成的沉淀与三氧化硫的物质的量之比为2:1,此段曲线斜率比①大;
④最后发生反应:2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O,沉淀的物质的量减小,
根据分析可知,生成沉淀与加入SO3的物质的量的关系相符的图象为D,
故选D.
点评 本题考查了混合物反应及应用,题目难度中等,明确发生反应的实质及先后顺序为解答关键,试题侧重考查学生的分析能力及灵活应用能力.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.00mol NaCl中含有6.02×1023个NaCl分子 | |
| B. | 欲配制1.00 L 1.00mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| C. | 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 | |
| D. | 电解58.5g 熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0g金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L O2作氧化剂时转移电子数一定为NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 已知3BrF3+5H2O═HBrO3+Br2+9HF+O2↑如果有5molH2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA | |
| D. | 142gNa2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
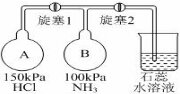
 ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.
ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.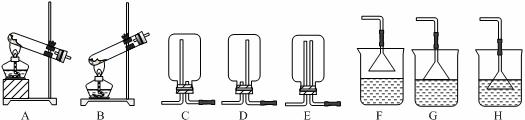
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol丙烯酸含有NA个不饱和键 | |
| B. | 标准状况下,11.2L的苯中含有3NA个碳氢键 | |
| C. | 0.1mol/L的Na3PO4溶液中含有的阴离子总数大于0.1NA | |
| D. | 1L1.0mol/L的Na2SiO3溶液中含有的氧原子数目大于3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com