
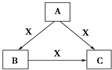
 A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )| A. | 若X为O2,则A可为硫化氢 | |
| B. | 若X为KOH溶液,则A可为AlCl3 | |
| C. | 若X为Cl2,则C可为FeCl3 | |
| D. | 若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2 |
分析 A.硫化氢与足量的氧气反应生成二氧化硫,氧气不足时生成S,硫与氧气反应得到二氧化硫;
B.若X为KOH溶液,A为AlCl3,B为Al(OH)3,C为KAlO2;
C.若X为Cl2,A为Fe,BC均为FeCl3;
D.若A、B、C均为焰反应呈黄色的化合物,说明含钠元素,转化关系中A可以是NaOH,X可以是二氧化碳或二氧化硫,B为碳酸钠或亚硫酸钠,C为碳酸氢钠或亚硫酸氢钠.
解答 解:A、硫化氢与足量的氧气反应生成二氧化硫,氧气不足时生成S,硫与氧气反应得到二氧化硫,若X为O2,A可为硫化氢,故A正确;
B、若X为KOH溶液,A为AlCl3,氯化铝与少量KOH反应生成B为Al(OH)3,氢氧化铝与KOH反应生成C为KAlO2,氯化铝与过量的KOH反应生成KAlO2,符合转化关系,故B正确;
C、若X为Cl2,A为Fe,Fe与氯气反应只能生成一种产物,所以BC均为FeCl3,不符合转化关系,故C错误;
D、若A、B、C均为焰反应呈黄色的化合物,说明含钠元素,转化关系中A可以是NaOH,X可以是二氧化碳或二氧化硫,B为碳酸钠或亚硫酸钠,C为碳酸氢钠或亚硫酸氢钠,故D正确;
故选C.
点评 本题考查了元素化合物性质与转化,注意掌握中学常见连续反应,熟练掌握元素化合物的性质是解题关键,题目难度不大,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:选择题
| A. | 被称为“史上最严”的新《环境保护法》正式实施,我们要运用化学原理从源头上减少和消除工业生产对环境的污染 | |
| B. | 天津港爆炸事故救援过程中,消防员若发现存放金属钠、电石、甲苯二异氰酸酯等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 | |
| C. | 世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命 | |
| D. | 某品牌化妆品在广告中反复强调产品中不含任何化学成分,是“十年专注自然护肤”的优质产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
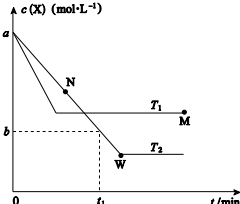 在恒容密闭容器中通入X 并发生反应:2X(g)?Y(g),温度T1、T2下X 的物质的量浓度c(X)随时间t 变化的曲线如图所示,下列叙述正确的是 ( )
在恒容密闭容器中通入X 并发生反应:2X(g)?Y(g),温度T1、T2下X 的物质的量浓度c(X)随时间t 变化的曲线如图所示,下列叙述正确的是 ( )| A. | 该反应进行到M 点放出的热量大于进行到W 点放出的热量 | |
| B. | T2 下,在0~t1 时间内,v(Y)═$\frac{a-b}{{t}_{1}}$mol•L-1•min-1 | |
| C. | M 点的平衡常数小于W 点的平衡常数 | |
| D. | M 点时再加入一定量X,平衡后X 的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 固体2是氧化铁 | |
| B. | X的化学式可以表示为Fe3C2 | |
| C. | 溶液甲加热、蒸发、灼烧也可得到24.0g固体 | |
| D. | X与足量的热浓硝酸反应有NO2和CO2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 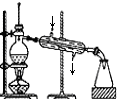 海水蒸馏得到淡水 | |
| B. | 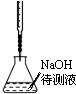 中和滴定 | |
| C. | 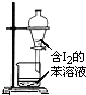 苯萃取碘水中I2,分出水层后的操作 | |
| D. | 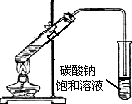 制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水吸收少量二氧化硫:NH3•H2O+SO2═NH4++HSO3- | |
| B. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3↑+H2O | |
| C. | 过量的铁粉与浓硝酸反应:Fe+4H++2NO3-═Fe2++2NO2↑+2H2O | |
| D. | 向漂白粉溶液中通入适量SO2:Ca2++2C1O-+SO2+H2O═CaSO3↓+2HC1O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
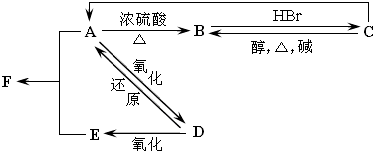
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com