
分析 (1)根据常见的吸热反应和放热反应类型回答,常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应、所有中和反应、绝大多数化合反应和铝热反应;常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、少数分解、置换以及某些复分解反应(如铵盐和强碱);
(2)较活泼金属作负极,电子由负极经导电流向正极,正极的电极反应式为Ag++e-=Ag,根据电子守恒计算析出的Ag和导线中通过的电子;
(3)反应物的总能量大于生成物的总能量为放热反应,反之,为吸热反应,中和反应属于放热反应,实质是H++OH-=H2O.
解答 解:(1)①煅烧石灰石是吸热反应;
②木炭燃烧是放热反应;
③炸药爆炸是放热反应;
④酸碱中和是放热反应;
⑤生石灰与水作用制熟石灰是放热反应;
⑥消石灰与氯化铵制备氨气是吸热反应;
故答案为:②③④⑤;①⑥;
(2)用锌片、铜片连接后浸入硝酸银溶液中,构成了原电池,Zn比Cu活泼,因此Zn作负极、Cu作正极,电子由负极经导电流向正极,即电路中电子的流向是从锌到铜,负极反应式为Zn-2e-=Zn2+,正极反应式为2Ag++2e-=2Ag,工作一段时间,Zn减少的物质的量为$\frac{3.25g}{65g/mol}$=0.05mol,失去的电子为0.05mol×2=0.1mol,则铜表面析出了银的物质的量为0.1mol,析出Ag的质量为0.1mol×108g/mol=10.8g,
故答案为:锌片;从锌到铜;Ag++e-=Ag;10.8;0.1;
(3)某化学反应,设反应物的总能量为E1,生成物的总能量为E2,若E1>E2,则该反应为放热反应,中和反应属于放热反应,实质是H++OH-=H2O,
故答案为:放;放;H++OH-=H2O.
点评 本题考查较为综合,涉及放热反应与吸热反应的判断、原电池原理及其计算以及中和反应的实质,题目难度不大,其中原电池的计算是该题的难点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
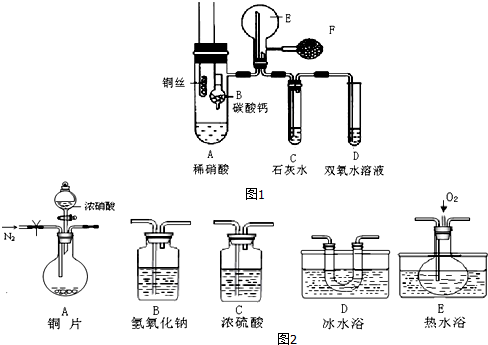
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应CH4+H2O $\frac{\underline{催化剂}}{△}$3H2+CO,每消耗1 mol CH4转移12 mol电子 | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-═2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
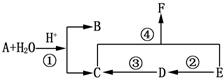
 .
.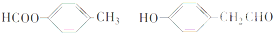 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
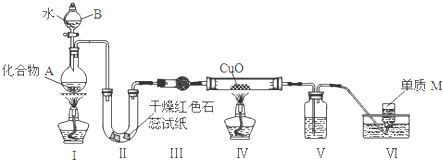
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com