
�����뻯ѧ��Ӧ�����仯��ص�������ȷ���� ����������
| A��Ӧ�ø�˹���ɣ��ɼ���ijЩ����ֱ�Ӳ����ķ�Ӧ�ʱ� |
| B��1 mol S��ȫȼ�շ���297.3 kJ�����Ȼ�ѧ����ʽ��S��O2=SO2����H����297.3 kJ��mol��1 |
| C��1 mol H2SO4��1 mol Ba��OH��2��Ӧ����1 mol BaSO4����ʱ�ų������������к��� |
| D����Ӧ�ȵĴ�С�뷴Ӧ�������е������������������е������� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���д�ʩ���ܴﵽ���ܼ���Ŀ�ĵ���
| A������̫��������ȼ�� | B���ü����������湫���� |
| C�����ó�ϫ�ܷ��� | D���ý��ܵƴ���׳�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���ɷ��Ǹ��л�ѧѧϰ���õķ���֮һ��ij��ѧ�о���ѧϰС����ѧϰ�ˡ���ѧ��Ӧԭ���������������µĹ����ܽ�����ڳ����£�
�� pH ��1��ǿ����Һ����ˮϡ�ͺ���Һ���������ӵ�Ũ�Ⱦ�����
�� pH��2�������pH��1�Ĵ��ᣬc��H����֮��Ϊ2��1
���ڵ����ʵ���Ũ�ȡ���������Ȼ�狀Ͱ�ˮ�Ļ����Һ�д������й�ϵc(NH4+)+2c(H+) =2c(OH-)+ c(NH3��H2O)
�ܷ�Ӧ2A (s) + B (g)��2C (g) + D (g) �����Է����У���÷�Ӧ��Hһ������0
����֪�������ƽ�ⳣ��ΪKa�������ˮ�ⳣ��ΪKh��ˮ�����ӻ�ΪKw�����߹�ϵΪ��Ka��Kh��Kw
�� ��ӦA��g�� 2B��g����������Ӧ�Ļ��ΪEa kJ��mol-1���淴Ӧ�Ļ��ΪEb kJ��mol-1����÷�Ӧ�ġ�H =��Ea��Eb��kJ��mol-1���������ȷ���� �� ��
2B��g����������Ӧ�Ļ��ΪEa kJ��mol-1���淴Ӧ�Ļ��ΪEb kJ��mol-1����÷�Ӧ�ġ�H =��Ea��Eb��kJ��mol-1���������ȷ���� �� ��
| A���٢ۢݢ� | B���ۢܢݢ� | C���ڢܢݢ� | D���٢ۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪�����Ȼ�ѧ����ʽ��
2Zn(s)��O2(g) �� 2ZnO(s)����H����702.2 kJ��mol��1
Hg(l)��1/2O2(g) �� HgO(s)����H����90.7 kJ��mol��1
�ɴ˿�֪Zn(s)��HgO(s) �� ZnO(s)��Hg(l)�ķ�Ӧ�Ȧ�HΪ( )
| A����260.4 kJ��mol��1 | B����260.4 kJ��mol��1 |
| C����611.5 kJ��mol��1 | D����520.8 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������������ȷ����( )
| A����ѧƽ�ⷢ���ƶ���ƽ�ⳣ����һ�������仯 |
| B�������¶Ȼ�����ѧ��Ӧ���ʣ���ԭ���������˻���ӵİٷ��� |
C��ij��ѧ��Ӧ�������仯��ͼ��ʾ����÷�Ӧ�Ħ�H��0����S��0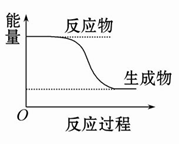 |
D��H3PO4�ĵ��볣��: 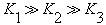 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����õ����ػ��ʹ�õ�����Һ��Ϊȼ�ռ���Һ��Ϊ�������ĸ��ܵ����ƽ�����
��֪��H2(g)��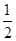 O2(g)=H2O(l)
O2(g)=H2O(l)
��H1����285.8 kJ��mol��1��
H2(g)=H2(l)����H2����0.92 kJ��mol��1��
O2(g)=O2(l)����H3����6.84 kJ��mol��1��
H2O(g)=H2O(l)����H4����44 kJ��mol��1��
����˵����ȷ����(����)
| A�������ĸ���Ӧ�������ȷ�Ӧ |
| B��1 molҺ̬H2����������1 mol��̬H2������ |
| C��H2��ȼ���Ȧ�HΪ��285.8 kJ��mol��1 |
D�������Һ��ȼ�յ��Ȼ�ѧ����ʽΪH2(l)��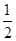 O2(l)=H2O(g)����H����285.8 kJ��mol��1 O2(l)=H2O(g)����H����285.8 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����Ȼ�ѧ����ʽ��д��ȷ���ǣ� ��
| A��C��s��+O2��g��=CO2��g����H=+393��5 kJ/mol |
| B��2SO+O2=2SO3��H=��196��6 kJ/mol |
| C��H2��g��+1/2O2��g��=H2O��l����H=��285��8 kJ/mol |
| D��2H2��g��+O2��g��=2H2O��l����H=��571��6 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����̼���á����Ե��ܺġ�����Ⱦ�����ŷ�Ϊ�����Ŀɳ�����չ�ľ���ģʽ������˵���롰��̼���á������ϵ��� (����)��
| A������ѹ����Ȼ������ȼ�� |
| B���ӿ컯ʯȼ�ϵĿ�����ʹ�ã�������ǵ�����ˮƽ |
| C�����ù�����Ƴɹ������װ�÷��� |
| D������̫���ܡ����ܵȣ����ٻ�ʯȼ�ϵ�ʹ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ�������£����ȼ��һ�����Ķ��飬�ų�����Ϊ
Q kJ��Q>0�������ⶨ��ȫ�������ɵĶ�����̼��Ҫ����5 mol��L-1��KOH��Һ100 mL��ǡ���������Σ���������·�ӦC4H10��g��+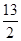 O2��g��=4CO2��g��+5H2O��g���Ħ�HΪ�� ��
O2��g��=4CO2��g��+5H2O��g���Ħ�HΪ�� ��
| A��+8Q kJ��mol��1 | B��-8Q kJ��mol��1 |
| C��+16Q kJ��mol��1 | D��-16Q kJ��mol��1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com