
 某兴趣小组同学研究了氧族元素及其某些化合物的部分性质,查阅资料如下:
某兴趣小组同学研究了氧族元素及其某些化合物的部分性质,查阅资料如下:分析 (1)从图象获取反应热的信息;
(2)依据反应自发进行的判断依据是△H-T△S<0分析;
(3))①H2(g)+S(s)═H2S(g)△H=-20.15kJ•mol-1
②S(s)+O2(g)═SO2(g)△H=-296.06kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-571.68kJ•mol-1
反应2H2S+3O2(g)═2SO2(g)+2H2O(l)可以是②×2-①×2+③得到,根据盖斯定律计算反应的焓变即可.
解答 解:(1)从图象可知,S与H2的△H<0,反应放出热量;
故答案为:放出;
(2)从图象可知,Te和H2反应的△H>0,而H2Te分解反应的△S>0,Te和H2化合的△S<0,则△H-T△S>0,反应不能自发进行;
故答案为:因为化合时△H>0,△S<0,△H-T△S>0,故反应不能自发进行;
(3)①H2(g)+S(s)═H2S(g)△H=-20.15kJ•mol-1
②S(s)+O2(g)═SO2(g)△H=-296.06kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-571.68kJ•mol-1
反应2H2S+3O2(g)═2SO2(g)+2H2O(l)可以是②×2-①×2+③得到,所以反应的焓变△H=2×(-296.06kJ•mol-1)-(-20.15kJ•mol-1)×2+(-571.68kJ•mol-1)=-1123.5kJ•mol-1,即2H2S+3O2(g)═2SO2(g)+2H2O(l)△H=-1123.5kJ•mol-1,
故答案为:2H2S+3O2(g)═2SO2(g)+2H2O(l)△H=-1123.5kJ•mol-1.
点评 本题主要借助于信息考查了反应热、反应的自发性以及盖斯定律的应用和热化学方程式的书写知识,难度不大,注意知识的积累是关键.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
 ;元素e的电子排布式为1s22s22p63s23p5,c的离子结构示意图为
;元素e的电子排布式为1s22s22p63s23p5,c的离子结构示意图为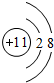
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L | |
| B. | 1 mol臭氧和1.5 mol氧气含有相同的氧原子数 | |
| C. | 等体积、浓度均为1 mol•L-1的磷酸和盐酸,H3PO4和HCl含有的氢元素质量之比为1:1 | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$ .写出C与NaOH水溶液共热反应的化学方程式
.写出C与NaOH水溶液共热反应的化学方程式 +3NaOH$→_{△}^{水}$
+3NaOH$→_{△}^{水}$ +2NaBr+H2O.
+2NaBr+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实 验 操 作 | 答案 | 实验现象 |
| (1)向鸡蛋清中滴加少许浓硝酸,微热 | B | A.紫色褪去 B.变黄色 C.出现蓝色 D.溶液分层,下层呈紫红色 |
| (2)将乙烯通入少量酸性KMnO4溶液中 | A | |
| (3)将CCl4滴入盛有碘水的试管中,充分振荡,静止 | D | |
| (4)向土豆片上滴加碘水 | C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4 OH-═2 Ba SO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+ $\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol•L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,100 mL 0.35 mol•L-1的KCl饱和溶液蒸发掉5g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com