
分析 (1)经过CaO吸收后,体积减少2.8L,n(C)=n(CO2)=$\frac{2.8L}{22.4L/mol}$=0.125mol;
剩余氧气:n(O2)=5.00L-0.56L-2.80L=1.64L,则反应氧气为:5L-1.64L=3.36L,物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,
由质量守恒可得m(H2O)=3.40 g+0.15mol×32 g•mol-0.125 mol×44 g•mol-1=2.7 g
n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,n(H)=0.3mol,再根据总质量计算出氧元素的质量及物质的量,再计算出该醇中C、H、O的原子个数之比;
(2)根据计算出的该醇中C、H、O的原子个数之比判断能否确定该醇的分子式;
(3)将该多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有一种,说明分子中-OH的化学环境都相同,结合有机物分子式确定其结构简式.
解答 解:(1)经过CaO吸收后,体积减少2.8L,n(C)=n(CO2)=$\frac{2.8L}{22.4L/mol}$=0.125mol;
剩余氧气:n(O2)=5.00L-0.56L-2.80L=1.64L,则反应氧气为:5L-1.64L=3.36L,物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,
由质量守恒可得m(H2O)=3.40 g+0.15mol×32 g•mol-0.125 mol×44 g•mol-1=2.7 g
n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,n(H)=0.300mol,醇中含O:$\frac{3.40g-0.3mol×1g/mol-0.125mol×12g/mol}{16g/mol}$=0.100mol,
则该醇中C、H、O的原子数之比为N(C):N(H):N(O)=0.125:0.3:0.1=5:12:4;
故答案为:0.125;0.300;0.100;5:12:4;
(2)由于该有机物的最简式C5H12O4中H原子个数已经饱和碳原子四价结构,所以能够确定其分子式,即:其实验式即为分子式,
故答案为:能;最简式C5H12O4中H原子个数已经饱和碳原子四价结构,所以最简式即分子式;
(3)将该多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有一种,说明分子中-OH的化学环境都相同,其结构简式为:C(CH2OH)4,
答:该饱和多元醇的结构简式为C(CH2OH)4.
点评 本题考查了有机物分子式、结构简式的确定的计算,题目难度中等,注意熟练掌握根据质量守恒确定有机物分子中C、H、O元素组成及数目的方法.注意最简式中H原子个数已经饱和碳原子四价结构,则实验式即为分子式.


科目:高中化学 来源: 题型:选择题
| A. | 两份质量相同的镁分别与足量氮气、二氧化碳反应,增重的质量相同 | |
| B. | 两份质量相同的硫分别与足量氢氧化钠和钠反应,两者转移的电子数相同 | |
| C. | 相同物质的量CO2、H2O分别与足量Na2O2反应,生成气体的体积相同 | |
| D. | 氢气分别通过灼热的CuO和Fe2O3粉末,当转移电子数相同时,固体减轻的质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
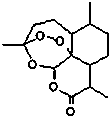 东晋医药学家葛洪的《肘后备急方•治寒热诸疟方》记载有“青蒿一握,以水二升渍,绞取汁,尽服之”的说法,说明不能加热青蒿,因高温可能使活性成分受损.中国药学家屠呦呦用沸点只有35℃的乙醚作为溶剂来提取青蒿素,创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.已知青蒿素的结构如图所示,下列有关青蒿素的说法,不正确的是( )
东晋医药学家葛洪的《肘后备急方•治寒热诸疟方》记载有“青蒿一握,以水二升渍,绞取汁,尽服之”的说法,说明不能加热青蒿,因高温可能使活性成分受损.中国药学家屠呦呦用沸点只有35℃的乙醚作为溶剂来提取青蒿素,创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.已知青蒿素的结构如图所示,下列有关青蒿素的说法,不正确的是( )| A. | 分子式为C15H22O5 | |
| B. | 能够发生水解反应 | |
| C. | 用沸点只有35℃的乙醚作为溶剂来提取青蒿素的方法化学上叫萃取 | |
| D. | 青蒿素能够治疗疟疾可能与结构中存在过氧键或酯基等基团有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1KHS溶液中c(HS-)+c(S2-)+c(H2S)=0.1mol•L-1 | |
| B. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | pH=11的NaOH溶液与pH=3的CH2COOH溶液等体积混合后c(CH2COO-)>c(Na+)>c(H+)>c(0H-) | |
| D. | 在K2CO3溶液中:c(CO32-)+c(OH-)=c(HCO3-)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
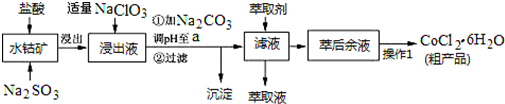
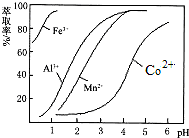
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 核外电子是分层运动的 | |
| B. | 所有电子在同一区域里运动 | |
| C. | 能量高的电子在离核近的区域运动 | |
| D. | 不同能量的电子在核外运动占有的区域形状可能不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com