
£Ø15·Ö£©ĢśŗĶĢśµÄ»ÆŗĻĪļŌŚ¹¤ŅµÉś²śŗĶČÕ³£Éś»īÖŠ¶¼ÓŠ¹ć·ŗµÄÓĆĶ¾£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ĢśŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ ”£
£Ø2£©Š“³öFeÓėĻ”ĮņĖį·“Ó¦µÄĄė×Ó·½³ĢŹ½ ”£
£Ø3£©ŅŃÖŖ£ŗFe2O3£Øs£©+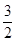 C£Øs£©=
C£Øs£©=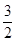 CO2£Øg£©+2Fe£Øs£©£»”÷H=+234.1kJ/mol
CO2£Øg£©+2Fe£Øs£©£»”÷H=+234.1kJ/mol
C£Øs£©+O2£Øg£©=CO2£Øg£©; ”÷H=-393.5kJ/mol£®
ĒėŠ“³öFe£Øs£©ÓėO2£Øg£©·“Ӧɜ³ÉFe2O3£Øs£©µÄČČ»Æѧ·½³ĢŹ½ ”£
£Ø4£©ŌŚŅ»¶ØĢõ¼žĻĀ£¬Ńõ»ÆĢśæÉŅŌÓėŅ»Ńõ»ÆĢ¼·¢ÉśĻĀĮŠ·“Ó¦£ŗ
Fe2O3£Øs£©+3CO£Øg£© 2Fe£Øs£©+3CO2£Øg£©;¹¤ŅµÉĻÓŠ16 t Fe2O3ŌŚ200m3µÄČŻĘ÷ÖŠ·“Ó¦£¬lŠ”Ź±ŗó²āµĆFe2O3µÄ×Ŗ»ÆĀŹĪŖ50%£¬ŌņÕā¶ĪŹ±¼äÄŚCOµÄĻūŗÄĖŁĀŹĪŖ mol/£ØL”¤h£©£®
2Fe£Øs£©+3CO2£Øg£©;¹¤ŅµÉĻÓŠ16 t Fe2O3ŌŚ200m3µÄČŻĘ÷ÖŠ·“Ó¦£¬lŠ”Ź±ŗó²āµĆFe2O3µÄ×Ŗ»ÆĀŹĪŖ50%£¬ŌņÕā¶ĪŹ±¼äÄŚCOµÄĻūŗÄĖŁĀŹĪŖ mol/£ØL”¤h£©£®
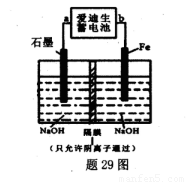
£Ø5£©°®µĻÉśŠīµē³ŲµÄ·“Ó¦Ź½ĪŖ£ŗFe+NiO2+2H2O Fe£ØOH£©2+Ni£ØOH£©2£»øßĢśĖįÄĘ£Ø Na2FeO4£©ŹĒŅ»ÖÖŠĀŠĶŅūĖ®Ļū¶¾¼Į£®ÓĆĢā29Ķ¼×°ÖĆæÉŅŌÖĘȔɣĮæøßĢśĖįÄĘ£®
Fe£ØOH£©2+Ni£ØOH£©2£»øßĢśĖįÄĘ£Ø Na2FeO4£©ŹĒŅ»ÖÖŠĀŠĶŅūĖ®Ļū¶¾¼Į£®ÓĆĢā29Ķ¼×°ÖĆæÉŅŌÖĘȔɣĮæøßĢśĖįÄĘ£®
¢Ł“Ė×°ÖĆÖŠ°®µĻÉśŠīµē³ŲµÄøŗ¼«ŹĒ____£ØĢī”°a”±»ņ"b”±£©£®
¢ŚŠ“³öŃō¼«µÄµē¼«·“Ó¦Ź½________£®
¢Ūµ±ÖʵĆ132£®8gøßĢśĖįÄĘŹ±£¬Ńō¼«Ēų¼õÉŁµÄŅõĄė×ÓµÄĪļÖŹµÄĮæĪŖ £®
£Ø1£©µŚĖÄÖÜĘŚ£¬¢ų×å£Ø2·Ö£©
£Ø2£©Fe£«2H£«= Fe2£«£«H2”ü£Ø2·Ö£©
£Ø3£©2Fe(s)£«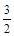 O2(g) = Fe2O3(s)
”÷H=£824.4kJ/mol£Ø3·Ö£©
O2(g) = Fe2O3(s)
”÷H=£824.4kJ/mol£Ø3·Ö£©
£Ø4£©0.75£Ø2·Ö£©
£Ø5£©¢Ła£Ø1·Ö£©
¢ŚFe£6e££«8OH££½FeO42££«4H2O£Ø3·Ö£© ¢Ū0.8mol£Ø2·Ö£©
”¾½āĪö”æ£Ø1£©ĢśµÄŌ×ÓŠņŹżŹĒ26£¬Ī»ÓŚµŚĖÄÖÜĘŚ£¬¢ų×唣
£Ø2£©ĢśŗĶĻ”ĮņĖį·“Ӧɜ³ÉĮņĖįŃĒĢśŗĶĒāĘų£¬·½³ĢŹ½ĪŖFe£«2H£«= Fe2£«£«H2”ü”£
£Ø3£©æ¼²éøĒĖ¹¶ØĀɵÄÓ¦ÓĆ”£øł¾ŻŅŃÖŖ·“Ó¦æÉÖŖ¢Ś”Į2/3£¢Ł¼“µĆµ½2Fe(s)£«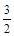 O2(g) = Fe2O3(s) £¬ĖłŅŌ·“Ó¦ČČŹĒ£393.5kJ/mol”Į3/2£234.1kJ/mol£½£824.4kJ/mol.
O2(g) = Fe2O3(s) £¬ĖłŅŌ·“Ó¦ČČŹĒ£393.5kJ/mol”Į3/2£234.1kJ/mol£½£824.4kJ/mol.
£Ø4£©lŠ”Ź±ŗó²āµĆFe2O3µÄ×Ŗ»ÆĀŹĪŖ50%£¬ŌņĻūŗÄŃõ»ÆĢśŹĒ8t£¬Ņņ“ĖĻūŗÄCOŹĒ
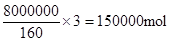 £¬ĖłŅŌĘä·“Ó¦ĖŁĀŹŹĒ
£¬ĖłŅŌĘä·“Ó¦ĖŁĀŹŹĒ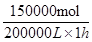 £½0.75mol/£ØL”¤h£©”£
£½0.75mol/£ØL”¤h£©”£
£Ø5£©¢ŁÖĘČ”øßĢśĖįÄĘ£¬ŌņĢśÓ¦øĆŹĒŃō¼«£¬ĖłŅŌaŹĒøŗ¼«£¬bŹĒÕż¼«”£
¢Śµē½ā³ŲÖŠŃō¼«Ź§Č„µē×Ó£¬øł¾ŻŃõ»Æ²śĪļŹĒøßĢśĖįÄĘæÉÖŖ£¬Ńō¼«µē¼«·“Ó¦Ź½ĪŖFe£6e££«8OH££½FeO42££«4H2O”£
¢Ū132£®8gøßĢśĖįÄĘŹĒ132.8g”Ā166g/mol£½0.8mol£¬ĖłŅŌøł¾Ż·½³ĢŹ½2H2O£«Fe£«2OH£ FeO42££«3H2”üæÉÖŖ£¬ĻūŗÄ1.6molOH££¬µ«Ķ¬Ź±Éś³É0.8molFeO42££¬ĖłŅŌ½įŹųŅõĄė×ÓŹĒ0.8mol”£
FeO42££«3H2”üæÉÖŖ£¬ĻūŗÄ1.6molOH££¬µ«Ķ¬Ź±Éś³É0.8molFeO42££¬ĖłŅŌ½įŹųŅõĄė×ÓŹĒ0.8mol”£


 ĘŚÄ©100·Ö“³¹Ųŗ£µķæ¼ĶõĻµĮŠ“š°ø
ĘŚÄ©100·Ö“³¹Ųŗ£µķæ¼ĶõĻµĮŠ“š°ø Š”ѧÄÜĮ¦²āŹŌ¾ķĻµĮŠ“š°ø
Š”ѧÄÜĮ¦²āŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 ĢśŗĶĢśµÄ»ÆŗĻĪļŌŚ¹¤ŅµÉś²śŗĶČÕ³£Éś»īÖŠ¶¼ÓŠ¹ć·ŗµÄÓĆĶ¾£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
ĢśŗĶĢśµÄ»ÆŗĻĪļŌŚ¹¤ŅµÉś²śŗĶČÕ³£Éś»īÖŠ¶¼ÓŠ¹ć·ŗµÄÓĆĶ¾£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
| ||
| ³äµē |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012½ģÖŲĒģŹŠøßČżæ¼Ē°Ä£Äā²āŹŌĄķæĘ×ŪŗĻŹŌĢā»ÆѧŹŌ¾ķ£Ø“ų½āĪö£© ĢāŠĶ£ŗĢīæÕĢā
£Ø15·Ö£©ĢśŗĶĢśµÄ»ÆŗĻĪļŌŚ¹¤ŅµÉś²śŗĶČÕ³£Éś»īÖŠ¶¼ÓŠ¹ć·ŗµÄÓĆĶ¾£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ĢśŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ ”£
£Ø2£©Š“³öFeÓėĻ”ĮņĖį·“Ó¦µÄĄė×Ó·½³ĢŹ½ ”£
£Ø3£©ŅŃÖŖ£ŗFe2O3£Øs£©+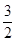 C£Øs£©=
C£Øs£©=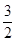 CO2£Øg£©+2Fe£Øs£©£»”÷H=+234.1kJ/mol
CO2£Øg£©+2Fe£Øs£©£»”÷H=+234.1kJ/mol
C£Øs£©+O2£Øg£©=CO2£Øg£©; ”÷H=-393.5kJ/mol£®
ĒėŠ“³öFe£Øs£©ÓėO2£Øg£©·“Ӧɜ³ÉFe2O3£Øs£©µÄČČ»Æѧ·½³ĢŹ½ ”£
£Ø4£©ŌŚŅ»¶ØĢõ¼žĻĀ£¬Ńõ»ÆĢśæÉŅŌÓėŅ»Ńõ»ÆĢ¼·¢ÉśĻĀĮŠ·“Ó¦£ŗ
Fe2O3£Øs£©+3CO£Øg£© 2Fe£Øs£©+3CO2£Øg£©;¹¤ŅµÉĻÓŠ16 t Fe2O3ŌŚ200m3µÄČŻĘ÷ÖŠ·“Ó¦£¬lŠ”Ź±ŗó²āµĆFe2O3µÄ×Ŗ»ÆĀŹĪŖ50%£¬ŌņÕā¶ĪŹ±¼äÄŚCOµÄĻūŗÄĖŁĀŹĪŖ mol/£ØL”¤h£©£®
2Fe£Øs£©+3CO2£Øg£©;¹¤ŅµÉĻÓŠ16 t Fe2O3ŌŚ200m3µÄČŻĘ÷ÖŠ·“Ó¦£¬lŠ”Ź±ŗó²āµĆFe2O3µÄ×Ŗ»ÆĀŹĪŖ50%£¬ŌņÕā¶ĪŹ±¼äÄŚCOµÄĻūŗÄĖŁĀŹĪŖ mol/£ØL”¤h£©£®
£Ø5£©°®µĻÉśŠīµē³ŲµÄ·“Ó¦Ź½ĪŖ£ŗFe+NiO2+2H2O Fe£ØOH£©2+Ni£ØOH£©2£»øßĢśĖįÄĘ£Ø Na2FeO4£©ŹĒŅ»ÖÖŠĀŠĶŅūĖ®Ļū¶¾¼Į£®ÓĆĢā29Ķ¼×°ÖĆæÉŅŌÖĘȔɣĮæøßĢśĖįÄĘ£®
Fe£ØOH£©2+Ni£ØOH£©2£»øßĢśĖįÄĘ£Ø Na2FeO4£©ŹĒŅ»ÖÖŠĀŠĶŅūĖ®Ļū¶¾¼Į£®ÓĆĢā29Ķ¼×°ÖĆæÉŅŌÖĘȔɣĮæøßĢśĖįÄĘ£®
¢Ł“Ė×°ÖĆÖŠ°®µĻÉśŠīµē³ŲµÄøŗ¼«ŹĒ____£ØĢī”°a”±»ņ"b”±£©£®
¢ŚŠ“³öŃō¼«µÄµē¼«·“Ó¦Ź½________£®
¢Ūµ±ÖʵĆ132£®8gøßĢśĖįÄĘŹ±£¬Ńō¼«Ēų¼õÉŁµÄŅõĄė×ÓµÄĪļÖŹµÄĮæĪŖ £®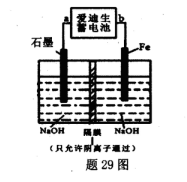
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ѧğø£½ØŹ”ĘĪĢļŹŠøßČż3ŌĀÖŹĮæ¼ģ²ā»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
(13·Ö)ĢśŗĶĢśµÄ»ÆŗĻĪļŌŚ¹¤ŅµÉś²śŗĶČÕ³£Éś»īÖŠ¶¼ÓŠ¹ć·ŗµÄÓĆĶ¾”£
£Ø1£©ŌŚ¶ØĻņ±¬ĘĘÖŠ£¬³£ĄūÓĆŃõ»ÆĢśÓėĀĮ·“Ó¦·Å³öµÄČČĮæĄ“ĒŠøīøÖ½ī£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ß£ß”£
£Ø2£©ŅŃÖŖ£ŗ2Fe2O3(s)£«3C(s)£½3CO2(g)£«4Fe(s)? ”÷H£½+468.2 kJ”¤mol-1
C(s)+O2(g)£½CO2(g) ”÷H=-393.5 kJ”¤mol-1”£
ŌņFe(s)ÓėO2 (g)·“Ӧɜ³ÉFe2 O3 (s)µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ß_____________________”£
£Ø3£©æÉÓĆKMnO4ČÜŅŗµĪ¶ØFe2+µÄÅØ¶Č£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ČēĻĀ£ŗ5Fe2£«£«MnO4££«8H£«£½5Fe3£«£«Mn2£«£«4H2O
¢ŁKMnO4ČÜŅŗÓ¦Ź¢·ÅŌŚ£ß£ß£ß£ß£ßµĪ¶Ø¹ÜÖŠ£»
¢ŚÅŠ¶Ļ“ļµ½µĪ¶ØÖÕµćµÄĻÖĻóŹĒ£ß£ß£ß£ß£ß£»
¢ŪÓĆĮņĖįĖį»ÆµÄ0.020 00 mol”¤L-1”£KMnO4ČÜŅŗµĪ¶ØijFeSO4ČÜŅŗÖĮÖÕµć£¬ŹµŃ鏿¾Ż¼ĒĀ¼ČēĻĀ±ķ£ŗ
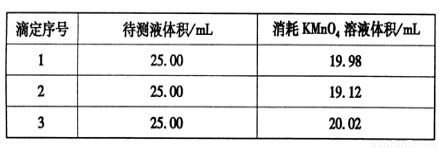
Ēė·ÖĪöŹż¾Ż²¢¼ĘĖć£¬øĆFeSO4ČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ£ß£ß£ß£ß£ß”£
£Ø4£©ŠĀŠĶÄÉĆײÄĮĻZnFe2Ox£¬æÉÓĆÓŚ³żČ„¹¤Ņµ·ĻĘųÖŠµÄijŠ©Ńõ»ÆĪļ”£ÖĘČ”ŠĀ²ÄĮĻŗĶ³żČ„·ĻĘųµÄ×Ŗ»Æ¹ŲĻµČēĻĀĶ¼£ŗ
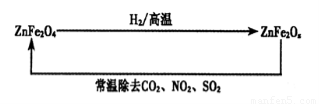
¢ŁŅŃÖŖZnFe2O4ÓėH2·“Ó¦µÄĪļÖŹµÄĮæÖ®±ČĪŖ2:1£¬ŌņZnFe2OxÖŠx=£ß£ß£ß£ß£ß£»
¢ŚÓĆZnFe2Ox³żČ„SO2µÄ¹ż³ĢÖŠ£¬Ńõ»Æ¼ĮŹĒ£ß£ß£ß£ß£ß”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012-2013ѧğŗŚĮś½Ź”¹ž¶ū±õĮłÖŠøßČż£ØÉĻ£©ĘŚÖŠ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗ½ā“šĢā
 Fe£ØOH£©2+Ni£ØOH£©2£»øßĢśĖįĖįÄĘ£ØNa2FeO4£©ŹĒŅ»ÖÖŠĀŠĶ¾»Ė®¼Į£®ÓĆĻĀĆę×°ÖĆæÉŅŌÖĘȔɣĮæøßĢśĖįÄĘ£®
Fe£ØOH£©2+Ni£ØOH£©2£»øßĢśĖįĖįÄĘ£ØNa2FeO4£©ŹĒŅ»ÖÖŠĀŠĶ¾»Ė®¼Į£®ÓĆĻĀĆę×°ÖĆæÉŅŌÖĘȔɣĮæøßĢśĖįÄĘ£®
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com