
| A、Fe2+、K+、ClO-、Cl- |
| B、Ag+、Na+、Cl-、NO3- |
| C、NH4+、K+、CO32-、Br- |
| D、H+、Ca2+、CH3COO-、HCO3- |
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳极93.6g,阴极121.6g |
| B、阳极100 g,阴极128.0g |
| C、阳极91.0g,阴极119.0g |
| D、阳极86.0g,阴极114.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温和同物质的量浓度时,HF比HCN易电离,则溶液pH:NaF>NaCN |
| B、物质的量浓度相等的H2S和NaHS混合溶液中:2c(Na+)═c(S2-)+c(HS-)+c(H2S) |
| C、0.1mol?L-1的醋酸溶液加水稀释,c(H+)、c(OH-)同比例减小 |
| D、体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等量的锌粉,前者用时长 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、手机上用的锂离子电池属于二次电池 |
| B、废旧电池应集中回收并填埋处理 |
| C、甲醇燃料电池可把化学能转化为电能 |
| D、锌锰干电池中,锌电极是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放电时电流从通人CH4的电极流向通入02的电极 |
| B、放电时溶液中的阳离子向负极移动 |
| C、放电时正极的电极反应式为02+2H2O+4e-=40H- |
| D、放电时溶液的PH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 催化剂 |
| 温度CO2% n(H2)/n(CO2) | 500K | 600K | 700K | 800K |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
| n(H2) |
| n(CO2) |
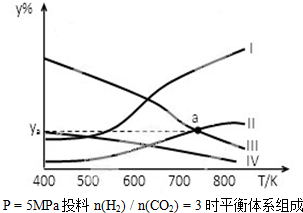 ①表示CH3CH2OH体积分数曲线的是
①表示CH3CH2OH体积分数曲线的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com